
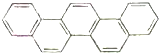
 第二十九届奥林匹克夏季运动会于2008年8月8日-24日在北京隆重举行并获得巨大成功.如图是酷似奥林匹克旗中五环的一种有机物,被称之为奥林匹克烃.下列说法正确的是( )
第二十九届奥林匹克夏季运动会于2008年8月8日-24日在北京隆重举行并获得巨大成功.如图是酷似奥林匹克旗中五环的一种有机物,被称之为奥林匹克烃.下列说法正确的是( )| A. | 该有机物的一氯代物共有四种 | |
| B. | 该有机物是只含非极性键的非极性分子 | |
| C. | 该有机物属于芳香族化合物,是苯的同系物 | |
| D. | 该有机物完全燃烧生成H2O的物质的量小于CO2的物质的量 |
分析 A.由结构对称性可知,分子中含6种H;
B.该有机物中含C-H键;
C.苯的同系物中只有苯环一个环状结构;
D.由结构可知,分子式为C22H14.
解答 解:A.由结构对称性可知,分子中含7种H,则该有机物的一氯代物有7种,故A错误;
B.该有机物中含C-H键,则既含极性键又含非极性键,故B错误;
C.苯的同系物中只有苯环一个环状结构,而该物质含多个苯环,属于芳香族化合物,但不属于苯的同系物,故C错误;
D.由结构可知,分子式为C22H14,1mol该物质燃烧生成22molCO2,7molH2O,燃烧生成H2O的物质的量小于CO2的物质的量,故D正确;故选D.
点评 本题考查有机物的结构与性质,为高考常见题型,把握官能团与性质的关系,熟悉燃烧规律及结构对称性即可解答,选项C为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在非金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 最外层电子数为8的粒子是稀有气体元素的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大多数化学反应在一定条件下都有一定的限度 | |
| B. | 化学反应在一定条件下达到限度时,正、逆反应速率都等于零 | |
| C. | 当某反应体系中气体压强不在改变时,该反应一定达到了反应限度 | |
| D. | 当某反应在一定条件下达到反应限度时,反应物和生成物的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
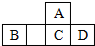 四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素原子核外电子总数是其最外层电子数的3倍.下列有关判断正确的是( )
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素原子核外电子总数是其最外层电子数的3倍.下列有关判断正确的是( )| A. | 简单氢化物的热稳定性:C>A | |
| B. | 最高价氧化物对应水化物的酸性:D<C | |
| C. | B的最高价氧化物的水化物能与D的最高价氧化物的水化物反应 | |
| D. | 常温下它们的单质均为固态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O; 化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的化学方程式为Na2O2+2H2O+Na2S=S↓+4NaOH.
;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O; 化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的化学方程式为Na2O2+2H2O+Na2S=S↓+4NaOH.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com