
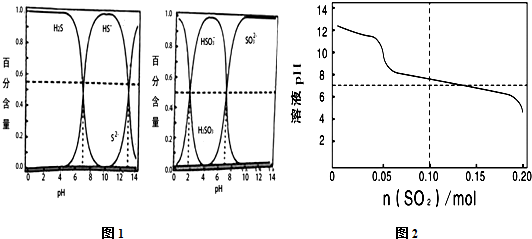
| A. | 由图1的一级电离与二级电离的Ka值可知H2SO3?2H++SO32- Ka≈10-7 | |
| B. | 向1L0.1 mol•L-1的Na2S溶液中持续通入SO2气体达到0.1 mol时,溶液中H2S、HS-、HSO3-、SO32-可同时一定量共存 | |
| C. | 向1L0.1 mol•L-1的Na2S溶液中持续通入SO2气体达到0.1 mol时,溶液中存在如下关系:c(H+)+c(Na+)═c(OH-)+2c(S2-)+2c(SO32-)+c(HS- )+c(HSO3-) | |
| D. | 在反应过程中当pH降至7.5左右,之后可能出现淡黄色沉淀 |
分析 A.题1中H2SO3-HSO3--SO32-粒子体系粒子体系随pH变化时各组分的分布情况可知,当PH=2时,c(H2SO3)=c(HSO3-),Ka1=10-2,PH=7时c(HSO3-)=c(SO32-),Ka2=10-2,依据电离平衡常数表达式计算分析;
B.向1L0.1 mol•L-1的Na2S溶液中持续通入SO2气体达到0.1 mol时,图2可知溶液PH=7,则由图1可知PH=7时c(H2S)=c(HS-),c(HSO3-)=c(SO32-),微粒可以共存;
C.向1L0.1 mol•L-1的Na2S溶液中持续通入SO2气体达到0.1 mol时图2可知溶液PH=7,则由图1可知PH=7时c(H2S)=c(HS-),c(HSO3-)=c(SO32-),溶液中H2S、HS-、HSO3-、SO32-可同时一定量共存,依据溶液中电荷守恒分析判断;
D.向1L0.1 mol•L-1的Na2S溶液中持续通入SO2气体达到0.1 mol时反应为Na2S+SO2+H2O=H2S+Na2SO3,继续通入二氧化硫,会发生反应2H2S+SO2=3S↓+2H2O;
解答 解:A.题1中H2SO3-HSO3--SO32-粒子体系粒子体系随pH变化时各组分的分布情况可知,当PH=2时,c(H2SO3)=c(HSO3-),Ka1=10-2,PH=7时c(HSO3-)=c(SO32-),Ka2=10-2,依据电离平衡常数表达式计算,H2SO3=?HSO3-+H+,HSO3-?H++SO32-,则H2SO3?2H++SO32- Ka=$\frac{c({H}^{+})c(HS{{O}_{3}}^{-})c({H}^{+})c(S{{O}_{3}}^{2-})}{c({H}_{2}S{O}_{3})c(HS{{O}_{3}}^{-})}$=Ka1×Ka2=10-5,故A错误;
B.图2可知溶液PH=7,则由图1可知PH=7时c(H2S)=c(HS-),c(HSO3-)=c(SO32-),溶液中H2S、HS-、HSO3-、SO32-可同时一定量共存,故B正确;
C.向1L0.1 mol•L-1的Na2S溶液中持续通入SO2气体达到0.1 mol时图2可知溶液PH=7,则由图1可知PH=7时c(H2S)=c(HS-),c(HSO3-)=c(SO32-),溶液中H2S、HS-、HSO3-、SO32-可同时一定量共存,溶液中电荷守恒c(H+)+c(Na+)═c(OH-)+2c(S2-)+2c(SO32-)+c(HS- )+c(HSO3-),故C正确;
D.向1L0.1 mol•L-1的Na2S溶液中持续通入SO2气体达到0.1 mol时,溶液PH=7,反应为Na2S+SO2+H2O=H2S+Na2SO3,继续通入二氧化硫,会发生反应2H2S+SO2=3S↓+2H2O,在反应过程中当pH降至7.5左右,之后可能出现淡黄色沉淀,故D正确;
故选A.
点评 本题考查了弱电解质电离平衡、图象变化分析、微粒随溶液PH变化的特征,主要是不同PH下物质反应的产物判断,电解质溶液中电荷守恒和电离平衡常数的实质是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
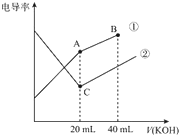
| A. | 曲线①代表0.1 mol/L KOH溶液滴定CH3COOH溶液的滴定曲线,曲线②代表0.1 mol/L KOH溶液滴定HCl溶液的滴定曲线 | |
| B. | 在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+) | |
| C. | 在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.05 mol/L | |
| D. | 在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
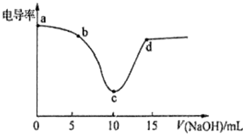
| A. | 电导率传感器能用于判断酸碱中和滴定的终点 | |
| B. | 该过程中,a点所示溶液的导电性最强 | |
| C. | c点电导率最小是因为此时溶液中导电微粒数目最少 | |
| D. | d点所示溶液中存在:c(Cl-)+c(OH-)=c(H+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 超级病菌NDM-l几乎对所有抗生素都具有抗药性,死亡率很高.为防止超级病菌的感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等氧化性强的物质 | |
| B. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| C. | 漂白粉在空气中变质是因为CaCl2与空气中的CO2反应生成 CaCO3 | |
| D. | 用热的纯碱溶液洗去油污是因为Na2CO3可直接与油脂反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某新型航天服材料主要成分是由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 | |
| B. | 玛瑙饰品的主要成分与建筑材料砂子相同 | |
| C. | 明矾净水时发生了化学及物理变化,能起到净水作用,而没有杀菌、消毒的作用 | |
| D. | 医用酒精是利用了乙醇的氧化性来杀菌消毒的 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去石英中混有的少量铝粉,可加入氢氧化钠溶液溶解后过滤 | |
| B. | 向含少量FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取,以除去FeCl2溶液中的FeBr2 | |
| C. | 除去乙酸乙酯中混有的少量乙酸,加入饱和氢氧化钠溶液振荡后分液 | |
| D. | 除去CuCl2溶液中混有的少量FeCl3,可向溶液中加入CuO后再过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com