
| A. | pH=3的 NH4Cl溶液与pH=3的盐酸中,水电离的c(H+)相等 | |
| B. | 25℃时将0.1mol•L-1 的HF加水不断稀释,$\frac{c({H}^{+})•c({F}^{-})}{c(HF)}$不变 | |
| C. | K2SO3溶液中加入少量NaOH固体,溶液的pH增大,SO32-水解程度减小 | |
| D. | pH=5的CH3 COOH 与CH3COONa混合溶液中,c(CH3COO-)<c(Na+) |
分析 A.易水解的盐促进水的电离,酸抑制水的电离;
B.弱酸的电离常数只与温度有关;
C.碱抑制强碱弱酸盐的水解;
D.pH=5的CH3 COOH 与CH3COONa混合溶液中,醋酸的电离程度大于醋酸钠的水解程度.
解答 解:A.pH=3的 NH4Cl溶液,铵根离子促进水的电离,溶液中氢离子全部由水电离,则水电离的氢离子为10-5mol/L,盐酸中酸电离的氢离子抑制水的电离,所以水电离的氢离子等于10-9mol/L,故A错误;
B.弱酸的电离常数只与温度有关,所以25℃时将0.1mol•L-1 的HF加水不断稀释,Ka=$\frac{c({H}^{+})•c({F}^{-})}{c(HF)}$,故B正确;
C.K2SO3在溶液中水解显碱性,在K2SO3溶液中加入少量NaOH固体,会抑制盐的水解,溶液的pH增大,SO32-水解程度减小,故C正确;
D.pH=5的CH3 COOH 与CH3COONa混合溶液,溶液显酸性,醋酸的电离程度大于醋酸钠的水解程度,则c(CH3COO-)>c(Na+),故D错误.
故选AD.
点评 本题考查了盐的水解、电离常数的影响因素、水的电离、离子浓度大小比较等,题目难度中等,侧重于考查学生的分析能力和对基础知识的综合应用能力,注意把握影响电离平衡的因素.


科目:高中化学 来源: 题型:选择题
| A. | 熵增加且放热的反应一定能自发进行 | |
| B. | 若可逆反应正、逆反应速率改变,则化学平衡一定发生移动 | |
| C. | 放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应 | |
| D. | 若某化学平衡发生移动,则平衡混合体系的压强一定发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气在空气中燃烧的反应 | |
| B. | 灼热的木炭与CO2的反应 | |
| C. | 铁粉与稀硫酸的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将铁片放入浓硫酸中 | 无明显现象 | 铁片发生了钝化 |
| B | 将SO2通入Na2CO3溶液中,将产生的气体再通入Na2SiO3溶液中 | 有白色沉淀生成 | 证明酸性: H2SO3>H2CO3>H2SiO3 |
| C | 向含有Fe3+的溶液中滴加KSCN溶液 | 溶液变红色 | 有Fe(SCN)3生成 |
| D | 向KOH溶液中滴加FeCl3溶液 | 有红褐色沉淀生成 | OH-+Fe3+=Fe(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.2g氧化钠和7.8g过氧化钠的混合物中含有的离子总数为0.6NA | |
| B. | 1mol铁粉在1mol氯气中充分燃烧,失去的电子数为3NA | |
| C. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.9NA个电子 | |
| D. | 等体积、浓度均为1mol•L-1的磷酸和盐酸,电离出的氢离子数之比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
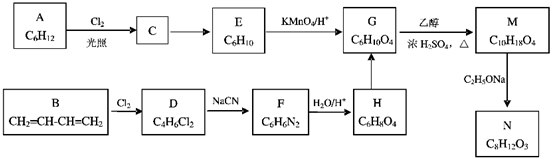
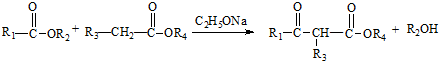
 .
.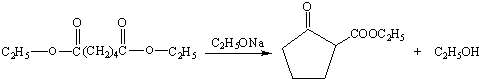 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:H2O>HF>H2S | B. | 最高正化合价:F>N>C | ||
| C. | 氧化性:Na+>A13+>Fe3+ | D. | 非金属性:Cl>S>Si |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com