
【题目】某溶液中加入氯化钡溶液生成白色沉淀,再加入稀硝酸沉淀不溶解也无气体逸出,则这种溶液中( )
A.一定含有SO42﹣
B.一定含有Ag+
C.可能不含CO32﹣
D.可能含有SO42﹣或Ag+
科目:高中化学 来源: 题型:
【题目】a、b、c、d为短周期元素,原子序数依次增大。25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol·L-1)的pH和原子序数的关系如图所示。下列有关说法正确的是

A. 简单离子半径:b>a
B. d元素氧化物的水化物一定是强酸
C. 气态氢化物的稳定性:d>c
D. b、c的简单离子都能破坏水的电离平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电化学原理将有机废水中的乙二胺[H2N(CH2)2NH2]转化为无毒物质的原理示意图如下图1所示,同时利用该装置再实现镀铜工艺示意图如图2所示,当电池工作时,下列说法正确的是

A. 图1中H+透过质子交换膜由右向左移动
B. 工作一段时间后,图2中CuSO4溶液浓度减小
C. 当Y电极消耗0.5 mol O2时,铁电极增重64 g
D. X 电极反应式:H2N(CH2)2NH2+16e-+4H2O═2CO2↑+N2↑+16H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铜跟稀硝酸反应:3Cu+ 8H++2NO![]() ===3Cu2++2NO↑+4H2O
===3Cu2++2NO↑+4H2O
B. 实验室用大理石和稀盐酸制取CO2:2H+ + CO![]() ===CO2↑+ H2O
===CO2↑+ H2O
C. 金属铁与醋酸反应:Fe+2H+===Fe2+ + H2↑
D. 钠与水反应: Na+H2O===Na++OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)可用于合成清洁剂,可由氯气与一氧化氮在常温常压下合成。熔点:-64.5℃,沸点:-5.5℃;常温下是黄色的有毒气体,遇水易水解。已知NO不与NaOH溶液反应。请按要求回答下列问题。
(1)过量铁屑和稀硝酸充分反应制备NO的离子方程式为_____________。其他条件相同,选用铁片比铜片制备NO的优点是_______________。
(2)制备NOCl的装置如下图所示,连接顺序为a→_______________(按气流自左向右方向,用小写字母表示)
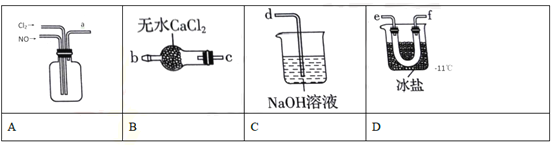
①装置A中反应的化学方程式:_______________。NOCl分子中各原子均满足8电子稳定结构,则它的电子式为_______________。
②若实验中没有安装装置B,其后果是_______________。
③实验开始应先在装置中通入Cl2,至装置A中充满黄绿色气体时,再将NO缓缓通入,此操作的目的是_______________。
(3)工业生产过程中NO尾气处理方法有多种,其中间接电化学法,其原理如图所示:
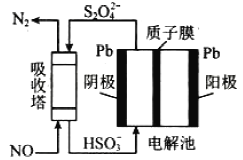
①吸收塔内发生的反应为_______________。
②阴极的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将定量的Na2CO3和NaHCO3的混合物加热到不再放出气体时,收集到CO2aL,冷却后向残余物中加入足量盐酸又收集到CO2 2 aL (体积均在标准状况下测定)。则混合物中Na2CO3和NaHCO3的物质的量之比为( )
A. 1:1 B. 1:2 C. 1:3 D. 1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电反应方程式为4Na+3CO2 =2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示,下列说法中错误的是( )
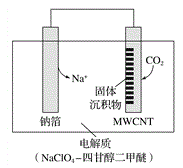
A. 电流流向为:MWCNT→导线→钠箔
B. 放电时,正极的电极反应式为 3CO2+4Na++4e-===2Na2CO3+C
C. 原两电极质量相等,若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为11.2g
D. 选用髙氯酸钠-四甘醇二甲醚做电解液的优点是导电性好,与金属钠不反应,难挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,在溶液中不能大量共存的是
A. H+、Cl-、Na+、NO3- B. Ag+、NO3-、Cl-、Na+
C. Ca2+、Na+、Cl-、K+ D. Na+、H+、Cl-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com