
| A.将①中所得浊液过滤,所得滤液中含少量Mg2+ |
B.浊液中存在溶解平衡:Mg(OH)2(s)  Mg2+(aq) + 2OH-(aq) Mg2+(aq) + 2OH-(aq) |
| C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶 |
| D.NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因 |
 Mg2++2OH-,将①中所得浊液氢氧化镁过滤,氢氧化镁存在沉淀溶解平衡:Mg(OH)2
Mg2++2OH-,将①中所得浊液氢氧化镁过滤,氢氧化镁存在沉淀溶解平衡:Mg(OH)2 Mg2++2OH-,所得滤液中含少量Mg2+,故A正确;浊液中存在沉淀溶解平衡:Mg(OH)2(s)
Mg2++2OH-,所得滤液中含少量Mg2+,故A正确;浊液中存在沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),故B正确;实验②中是因为剩余的氢氧化钠和氯化铁之间反应生成氢氧化铁的缘故,不能说明Fe(OH)3比Mg(OH)2难溶,故C错误;氢氧化镁存在沉淀溶解平衡:Mg(OH)2
Mg2+(aq)+2OH-(aq),故B正确;实验②中是因为剩余的氢氧化钠和氯化铁之间反应生成氢氧化铁的缘故,不能说明Fe(OH)3比Mg(OH)2难溶,故C错误;氢氧化镁存在沉淀溶解平衡:Mg(OH)2 Mg2++2OH-,加氯化铵,会和氢氧根离子之间反应,所以平衡正向移动,沉淀溶解,故D正确,
Mg2++2OH-,加氯化铵,会和氢氧根离子之间反应,所以平衡正向移动,沉淀溶解,故D正确,

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源:不详 题型:填空题
| A.x ="0.5" ,a =8 | B.x =0.5,a = 10 |
| C.x =" 1.5" ,a =8 | D.x =" 1.5" ,a = 10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.具有吸附性 |
| B.溶解度与CuS、PbS、CdS等相同 |
| C.溶解度大于CuS、PbS、CdS |
| D.溶解度小于CuS、PbS、CdS |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | 冷轧含锌 废水水质 | 经处理后的水国 家环保标准值 |
| Zn2+浓度/(mg·L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
| SO42-浓度/(mg·L-1) | ≤23 000 | ≤150 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
| B.Cu2++H2S=CuS↓+2H+ |
| C.Zn2++S2-+2H2O=Zn(OH)2↓+H2S↑ |
| D.FeS+2H+=Fe2++H2S↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中所含溶质的离子浓度大小关系为:c(K+)>c(NO3—)>c(Cl-)>c(I-)>c(Ag+) |
| B.溶液中先产生的是AgI沉淀 |
| C.AgCl的Ksp的数值为1.69×10-10 |
| D.若在AgI悬浊液中滴加少量的KCl溶液,黄色沉淀不会转变成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
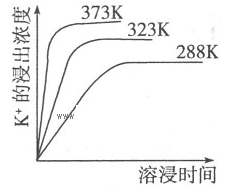
| A.向该体系中加入饱和NaOH溶液,溶解平衡向右移动 |
| B.向该体系中加入饱和碳酸钠溶液,溶解平衡向右移动 |
| C.该平衡的Ksp=c(Ca2+)·c(K+)·c(Mg2+)·c(SO42-) |
| D.升高温度,反应速率增大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com