
下列离子方程式表达正确的是( )
A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B.小苏打溶液呈碱性的原因:HCO3-+H2O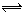 H3O++CO32-
H3O++CO32-
C.溴化亚铁溶液中通入足量氯气:2Fe2++ 4Br-+ 3Cl2 = 2Fe3++2 Br2 + 6Cl-
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液:
NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:选择题
下列判断中一定正确的是
A.若X、Y都是气态氢化物,且相对分子质量:X﹥Y,则沸点:X﹥Y
B.若X、Y属于同主族元素,且相对原子质量:X﹥Y,则X的失电子能力比Y强
C.若R2-和M+的电子层结构相同,则原子序数:R﹥M
D.若M、N是同主族元素,且原子序数:M﹥N,则非金属性:M﹥N
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:选择题
下列比较或归纳正确的是
A.稳定性:NH3<PH3<ASH3
B.离子半径:Cl->S2->Al3+
C.酸性:HClO4>H2SO4>H3PO4
D.碱性:Be(OH)2>Mg(OH)2>Al(OH)3
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省大冶市春季期末考试高二化学试卷(解析版) 题型:填空题
(8分)有一瓶澄清的溶液,其中可能含有NH4+、K+、 Ba2+、Al3+、Fe3+、 I-、NO3-、CO32-、SO42-、AlO2- 。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性。
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。
③另取溶液适量,逐滴加入NaOH溶液:a.溶液从酸性变为中性;b.溶液逐渐产生沉淀;c.沉淀完全溶解;d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
④取适量③得到的碱性溶液加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除 离子的存在。
(2)由②可以证明 离子的存在,同时排除 离子存在。理由是_________________________。
(3)由③可证明 离子存在。
(4)由④可以排除 离子存在,同时证明 离子的存在。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省大冶市春季期末考试高二化学试卷(解析版) 题型:选择题
下列实验操作与预期实验目的或结论均正确的是( )
选项 | 实验操作 | 预期实验目的或结论 |
A | 室温下,用pH试纸测定浓度为0.1mol·L-1 Na2SiO3溶液和Na2CO3溶液的pH | 比较Si和C的电负性 |
B | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中含有SO42- |
C | 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
D | 将某气体通入淀粉和KI的混合溶液,溶液变蓝色 | 该气体一定是Cl2 |
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省大冶市春季期末考试高二化学试卷(解析版) 题型:选择题
下列表述不正确的是( )
A.131I与127I互为同位素,化学性质几乎相同
B.pm 2. 5含有铅、镉、铬、钒等对人体有害的金属元素
C.除去SO2中混有的少量HCl,使气体通过盛有饱和NaHSO3溶液的洗气瓶
D.为了证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省四校下学期期中考试高一化学试卷(解析版) 题型:选择题
已知:25℃,101KPa下,固体白磷、固体红磷分别充分燃烧,放出热量如下:
①P(s,白磷)+5/4 O2(g)= 1/4 P4O10(s) 放出755.2kJ的热
②P(s,红磷)+5/4 O2(g)= 1/4 P4O10(s) 放出738.5kJ的热
据此判断下列说法中正确的是
A.由白磷变红磷是吸热反应
B.白磷、红磷都是磷的单质,相互可以自由转化,不吸热,也不放热
C.等质量时,白磷比红磷具有的能量高
D.等物质的量时,断白磷分子中的键比断红磷分子中的键消耗的能量多
查看答案和解析>>
科目:高中化学 来源:2013-2014海口市第二学期高二化学期中考试(B卷)试卷(解析版) 题型:填空题
(13分)有机合成中增长碳链是一个重要环节。如下列反应:

用  通过以下路线可合成(Ⅱ):
通过以下路线可合成(Ⅱ):

(1)(Ⅰ)的分子式为 ;(Ⅲ)的结构简式为 。
(2)(Ⅱ)与足量的热NaOH溶液反应的化学方程式为 。
(3) 在生成(Ⅲ)时,还能得到另一种副产物C6H8O4,该反应的化学方程式为 ,反应类型是 。
在生成(Ⅲ)时,还能得到另一种副产物C6H8O4,该反应的化学方程式为 ,反应类型是 。
(4)(Ⅰ)的一种同分异构体(Ⅳ)能发生银镜反应,还能水解生成不含甲基的芳香化合物。(Ⅳ)的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省湖州市高三二模理综化学试卷(解析版) 题型:填空题
(14分)无机物A是一种固体,熔点178℃,30℃以下为浅黄色。经测定A(相对分子质量为184)含两种元素,原子个数比为1:1。隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色。该淡黄色物质在空气中加热会燃烧并产生刺激性气味。在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42克化合物D。加热D发现无任何物质存在,把D溶于水测得溶液的pH小于7。已知气体C在标准状况下的密度为0.76g·L-1。
(1)A的化学式为 ,C的电子式 。
(2)写出SCl2和气体C反应的化学方程式 。
(3)1molSCl2能与2mol乙烯发生加成反应生成一种化学毒气芥子气,写出发生反应的化学方程式 。
(4)亚硝酸钠和D固体在加热条件下 (填“可能”或“不能”)发生反应,判断理由是 。
(5)请设计检验物质D的实验方案 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com