
| A. | 由H2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色变深 | |
| B. | 红棕色的NO2,加压后颜色先变深后变浅 | |
| C. | 实验室用排饱和食盐水法收集氯气 | |
| D. | 工业上利用O2与SO2反应制取SO3时通入过量O2 |
分析 平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释.
解答 解:A.存在平衡H2+I2(g)?2HI(g),该反应前后气体的体积不变,增大压强,平衡不移动,增大平衡体系的压强气体的体积减小,碘的浓度增大,颜色变深,不能用平衡移动原理解释,故A选;
B.存在平衡2NO2(g)?N2O4(g),增大压强,混合气体的浓度增大,平衡体系颜色变深,该反应正反应为体积减小的反应,增大压强平衡正反应移动,二氧化氮的浓度又降低,颜色又变浅,由于移动的目的是减弱变化,而不是消除,故颜色仍比原来的颜色深,所以可以用平衡移动原理解释,故B不选;
C.实验室用排饱和食盐水法收集氯气,利用饱和食盐水中氯离子浓度使平衡逆向进行,Cl2+H2O?H++Cl-+HClO,可以用勒夏特列原理解释,故C不选;
D.工业上利用O2与SO2反应制取SO3时通入过量O2,增大氧气浓度,平衡正向移动,所以可以用勒夏特里原理解释,故D不选;
故选A.
点评 本题考查勒夏特列原理知识,题目难度不大,注意使用勒夏特列原理的前提必须是可逆反应,且是否发生平衡的移动.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2O的质量为18g/mol | |
| B. | 标准状况下,1 mol任何物质体积均为22.4L | |
| C. | CH4的摩尔质量为16g | |
| D. | 6.02×1023个O2分子的质量为32g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 C和Si元素在化学中占有极其重要的地位.
C和Si元素在化学中占有极其重要的地位.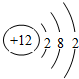 ;MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,则每个M2+周围吸引6个O2-;每个MO晶胞中含有4个M2+和4个O2-; MO的熔点比CaO的高,其原因是Mg 2+半径比Ca 2+小,MgO的晶格能大.
;MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,则每个M2+周围吸引6个O2-;每个MO晶胞中含有4个M2+和4个O2-; MO的熔点比CaO的高,其原因是Mg 2+半径比Ca 2+小,MgO的晶格能大.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
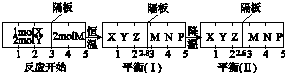
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com