
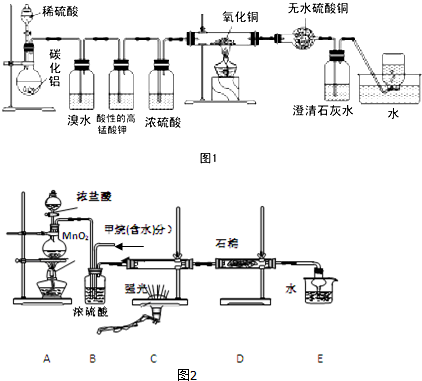
分析 (1)根据碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷可知碳化铝与硫酸反应生成硫酸铝和甲烷;
(2)根据实验甲的实验目的和甲烷的性质进行解答,若集气瓶中收集到的气体属于有毒气体,则不能排放到空气中,反之能;
(3)A.若甲烷能与强氧化剂反应,酸性高锰酸钾溶液褪色;
B.硬质试管里黑色粉末无颜色变化,可能为铜、氧化铜或氧化亚铜的混合物;
C.氧化铜与甲烷反应生成水和二氧化碳、一氧化碳,硬质试管里黑色粉末也能变红色;
D.甲烷能与卤素单质发生取代反应;
(4)B装置进行气体干燥,并均匀混合气体,根据气泡可以控制气体流量;
(5)甲烷完全取代生成CCl4时获得的HCl最多;
(6)碘化钾能与剩余的氯气反应;
(7)最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离;
(8)一氯甲烷是气体,还可能有过量的甲烷.
解答 解:(1)碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷,碳化铝与硫酸反应可理解为碳化铝(Al4C3)与水反应,产物再和硫酸反应,所以产物为硫酸铝和甲烷,反应方程式为:Al4C3+6H2SO4=2Al2(SO4)3+3CH4↑,
故答案为:Al4C3+6H2SO4=2Al2(SO4)3+3CH4↑;
(2)碳化铝与硫酸反应生成硫酸铝和甲烷,甲方案探究甲烷与氧化剂反应,盛放浓硫酸的装置放置在氧化剂氧化铜之前,所以实验甲中浓硫酸的作用是干燥CH4,甲烷和氧化铜反应,碳元素化合价升高,生成碳的氧化物,产物中可能有一氧化碳生成,所以集气瓶中收集到的气体不能直接排放到空气中,
故答案为:干燥CH4;否;
(3)A.甲烷不能与强氧化剂反应,若能反应,则酸性高锰酸钾溶液在甲烷的作用下会褪色,现不褪色,结论是通常条件下,甲烷不能与强氧化剂反应,故A正确;
B.甲烷能与氧化铜反应,当少量甲烷参加反应,硬质试管里为大量黑色粉末氧化铜和少量铜的混合物,业可能为氧化亚铜,现象无颜色变化,结论是甲烷不与氧化铜反应时错误的,故B错误;
C.氧化铜与甲烷反应生成水和二氧化碳、一氧化碳,硬质试管里黑色粉末也能变红色,故C错误;
D.甲烷不能与溴水反应,但甲烷能与卤素单质发生取代反应,故D错误;
故答案为:A;
(4)因浓硫酸具有吸水性,可以干燥气体,并均匀混合气体,根据气泡可以控制气体流速,
故答案为:干燥甲烷和氯气;
(5)甲烷完全取代生成CCl4时获得的HCl最多,由CH4+4Cl2$\stackrel{光照}{→}$CCl4+4HCl,可知$\frac{V(C{l}_{2})}{V(C{H}_{4})}$≥4,
故答案为:≥4;
(6)碘化钾能与剩余的氯气反应,吸收过量的氯气,
故答案为:除去未反应掉的氯气;
(7)E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可用分液方法分离,
故答案为:A;
(8)反应生成的二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,只有一氯甲烷是气体,还可能有过量的甲烷,
故选AB,
故答案为:AB.
点评 本题考查了化学实验,涉及氯气的制备、物质的分离提纯、甲烷与氯气的取代反应等,侧重对装置与原理的考查,掌握常见物质分离提纯方法,注意渗透环保意识,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. |  打磨磁石制指南针 | B. |  烧结粘土制陶瓷 | ||
| C. |  湿法炼铜 | D. |  铁的冶炼 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的转化率变小 | B. | 平衡向逆反应方向移动 | ||
| C. | D的质量百分数变大 | D. | a<c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ②④⑥ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 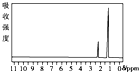 | C. | 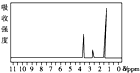 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用热的纯碱溶液去油污 | |
| B. | pH=3的醋酸溶液,加水稀释10倍后pH<4 | |
| C. | 实验室配置FeCl3溶液时,加入少量稀盐酸,以防止溶液浑浊 | |
| D. | 草木灰与铵态氮肥不能混合施用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com