

分析 (1)根据盖斯定律可以计算化合反应的焓变,根据反应自发行的判据:△H-T△S<0进行回答;
(2)①根据图示CO2的平衡转化率和反应温度的关系来判断回答;
②a.根据速率v=$\frac{△c}{△t}$结合三行式进行计算;
b.化学反应的平衡常数K各个生成物平衡浓度系数次方的乘积和各个反应物平衡浓度系数次方乘积的比值,据此计算;
c.将体系温度升至600K,根据升高温度,平衡向着吸热方向来进行回答;
(3)①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,只要加快反应速率且使得平衡正向移动的因素都可以;
②根据反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO来回答.
解答 解:(1)反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反应Ⅱ:CO2(g)+H2(g)?CO (g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ•mol-1
根据盖斯定律,反应Ⅱ可以是Ⅰ-Ⅲ得到,所以反应Ⅱ的焓变△H2=(-49.58kJ•mol-1)-(-90.77kJ•mol-1)=+41.19 kJ•mol-1;根据反应自发行的判据:△H-T△S<0,反应Ⅲ是熵减的放热的反应,所以要自发进行需要在较低温下进行,
故答案为:+41.19 kJ•mol-1;较低温;
(2)①据图可知,若要使CO2的平衡转化率大于40%,需要n(H2)=3mol,n(CO2)的物质的量大于1.7mol,温度高于550K,故选B;
②在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡,二氧化碳的转化率是60%,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始浓度:0.75 1.5 0 0
变化浓度:0.45 1.35 0.45 0.45
平衡浓度:0.3 0.15 0.45 0.45
a.氢气表示的反应速率=$\frac{1.35mol/L}{10min}$=0.135 mol•L-1•min-1,故答案为:0.135 mol•L-1•min-1;
b.该温度下,反应I的平衡常数K=$\frac{0.45×0.45}{0.3×0.1{5}^{3}}$=200,故答案为:200;
c.当反应时间达到3min时,迅速将体系温度升至600K,则平衡正向进行,甲醇的浓度会增加,图象为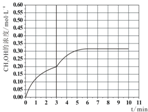 ,
,
故答案为: ;
;
(3)①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,只要加快反应速率且使得平衡正向移动即可.
A.改用高效催化剂,能加快反应速率,但是不影响平衡的移动,故错误;
B.升高温度,加快反应速率且使得平衡逆向移动,不符合,故错误;
C.缩小容器体积,即增大压强,加快反应速率且使得平衡正向移动,故正确;
D.分离出甲醇,不能加快反应速率,故错误;
E.增加CO2的浓度,可以加快反应速率且使得平衡正向移动,故正确.
故选CE;
②反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO,所以当温度高于260℃后,CO的浓度一定增大,
故答案为:增大.
点评 本题综合考查学生盖斯定律的应用、化学反应速率的计算、化学平衡移动的影响因素等知识,属于综合知识的考查,难度较大.


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:选择题
| A. | 孤电子对与成键电子对间的斥力大于成键电子对间的斥力 | |
| B. | 孤电子对与成键电子对间的斥力小于成键电子对间的斥力 | |
| C. | 孤电子对与成键电子对间的斥力等于成键电子对与成键电子对间的斥力 | |
| D. | 题干中的数据不能说明孤电子对与成键电子对间的斥力与成键电子对与成键电子对间的斥力之间的大小关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的熔、沸点低 | |
| B. | 钠的颜色是银白色的 | |
| C. | 钠与空气中氧气反应,条件不同产物不同 | |
| D. | 因为反应要加热,所以该反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用二氧化碳制造全降解塑料,可以减缓二氧化碳对环境的影响 | |
| B. | 用福尔马林灭活埃博拉病毒是利用了蛋白质变性原理 | |
| C. | 光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用 | |
| D. | 酸碱质子理论认为,凡能给出质子(H+)的物质都是酸,凡能接受质子的物质都是碱.根据这一理论,Al(OH)3、NaHCO3都是酸碱两性物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3g钠与水反应失去的电子数目为0.2NA | |
| B. | 20℃、101Kpa时,5.6L氨气所含的原子数目为NA | |
| C. | 0℃、101Kpa时,18g铵根离子所含有的电子数为10NA | |
| D. | 1mol氯化钠固体溶于1L水所得的溶液中氯化钠的物质的量浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
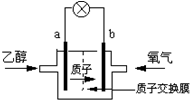 美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )| A. | a极为电池的负极 | |
| B. | 电池工作时电流由b极沿导线经灯泡再到a极 | |
| C. | 电池正极的电极反应为:2H++O2+4e-═H2O | |
| D. | 电池工作时1mol乙醇被氧化时就有6mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种气体质量相等 | B. | 两种气体的物质的量之比为16:1 | ||
| C. | 两种气体压强比为16:1 | D. | 两种气体体积比为1:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
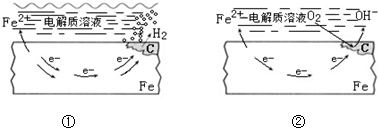
| A. | ①、②中的Fe都发生的是还原反应 | |
| B. | ①表面的电解质溶液可以为NaCl溶液 | |
| C. | 生活中钢铁制品的腐蚀以图①所示为主 | |
| D. | 图②中,正极反应式为O2+4e-+2H2O═4OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com