
| A. | 1mol 氢 | B. | 1mol O | C. | 1mol 二氧化碳 | D. | 1mol 水 |
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr 的沸点依次升高 | |
| B. | O、S、Na、K 的原子半径依次增大 | |
| C. | H2S、PH3、HCl、HF 的热稳定性依次增强 | |
| D. | Mg(OH)2、Al(OH)3、KOH、Ca(OH)2 的碱性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | WX2分子中所有原子最外层都为8 电子结构 | |
| B. | WX2、ZX2的化学键类型相同 | |
| C. | WX2是以极性键结合成的分子 | |
| D. | 原子半径大小顺序为X<W<Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
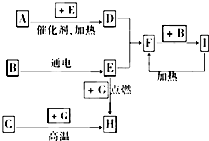 下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去,常温下,G为固体单质,B、I为液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C. H可用作工业上冶炼金属的还原剂.请按要求填空:
下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去,常温下,G为固体单质,B、I为液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C. H可用作工业上冶炼金属的还原剂.请按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
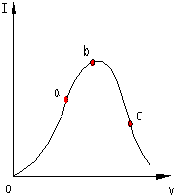 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
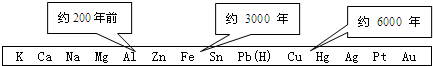
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com