
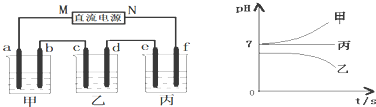
分析 乙中c电极质量增加,说明c属于阴极,所以d是阳极,则M是负极,N是正极,f是阳极,e是阳极,b是阳极,a是阴极,根据电解后溶液pH的变化可知甲中的电解质是NaCl,乙中的电解质是CuSO4,丙中的电解质是Na2SO4,根据电解池的工作原理结合电极反应式进行计算即可.
解答 解:乙中c电极质量增加,说明c属于阴极,所以d是阳极,则M是负极,N是正极,f是阳极,e是阳极,b是阳极,a是阴极,根据电解后溶液pH的变化可知甲中的电解质是NaCl,乙中的电解质是CuSO4,丙中的电解质是Na2SO4,
(1)乙烧杯为电解硫酸铜溶液,反应的总反应式为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+H2SO4,
故答案为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+H2SO4;
(2)丙为电解硫酸钠溶液,f为阳极,电极f上发生的电极反应为4OH--4e-=2H2O+O2↑,
故答案为:4OH--4e-=2H2O+O2↑;
(3)c电极质量增加了8g,为Cu,n(Cu)=$\frac{8g}{64g/mol}$=0.125mol,转移0.25mol电子,
丙中发生2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑,转移0.25mol电子应消耗0.125mol水,质量为0.125mol×18g/mol=2.25g,应加入2.25g水可恢复到原来的浓度,
故答案为:向丙烧杯中加入水2.25g.
点评 本题考查电解池的工作原理知识,注意电解中最关键的是准确判断出电极上离子的放电顺序,在判断电解产物时,首先判断阳极电极材料.如果是活性电极,则电极本身失去电子.如果是惰性电极,则溶液中的阴离子失去电子,而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(g)△H=-Q1kJ/mol; 2H2(g)+O2(g)=2H2O(g))△H=-Q2kJ/mol | |
| B. | S(g)+O2(g)=SO2(g)△H=-Q1kJ/mol; S(s)+O2(g)=SO2(g))△H=-Q2kJ/mol | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO2(g))△H=-Q1kJ/mol; C(s)+O2(g)=CO(g))△H=-Q2kJ/mol | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H=-Q1kJ/mol; $\frac{1}{2}$H2(g)+Cl2(g)=HCl(g))△H=-Q2kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧元素的相对原子质量为$\frac{12a}{b}$ | B. | 1mol该原子质量为aNAg | ||
| C. | x g该氧原子所含的电子数为$\frac{8x}{a}$ | D. | y g 该氧原子的中子数一定为$\frac{8y}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com