
| A.向其中放入过量镁条,反应完毕后取出 |
| B.蒸馏 |
| C.加入能氧化I2的KMnO4,再分液 |
| D.通入氯气 |
科目:高中化学 来源:不详 题型:单选题
| | 物质 | 杂质 | 除杂试剂或操作方法 |
| ① | 酒精 | 水 | 蒸馏 |
| ② | H2 | CO2 | 通过盛有NaOH溶液洗气瓶,再通过盛有浓硫酸洗气瓶 |
| ③ | NaNO3 | CaCO3 | 溶解、过滤、蒸发 |
| ④ | NaCl | I2 | 加热 |
| ⑤ | KNO3溶液 | AgNO3 | 加入NaCl溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.除去CO中混有的CO2:用氢氧化钠溶液洗气 |
| B.用AlCl3溶液和过量氨水制备Al(OH)3 |
| C.用足量铜粉除去FeCl2溶液中的FeCl3杂质 |
| D.用排水法收集稀HNO3和Cu反应产生的NO气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
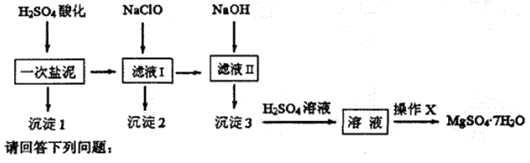
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
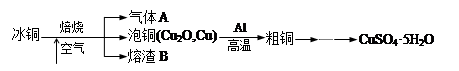
|

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验目的 | 实验步骤及现象 |
| A | 检验亚硫酸钠试样是否变质 |  |
| B | 检验某卤代烃是否是氯代烃 |  |
| C | 证明酸性条件H2O2氧化性比I2强 |  |
| D | 除去铁屑表面的油污 | 铁屑用热的碳酸钠溶液洗涤,再用蒸馏水冲洗干净 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
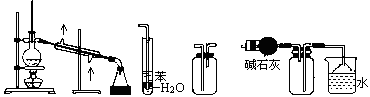
| A.装置①常用于分离互相溶解且沸点相差10℃以上的液态混合物 |
| B.装置②可用于吸收NH3或HCl气体,并防止到吸 |
| C.装置③可用于收集H2、CO2、Cl2、NH3等气体 |
| D.装置④可用于干燥、收集氨气,若将碱石灰改成五氧化二磷,可用于干燥、收集氯化氢 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
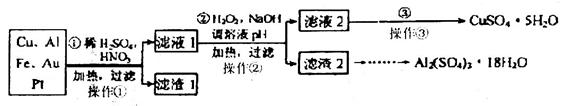
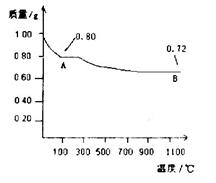
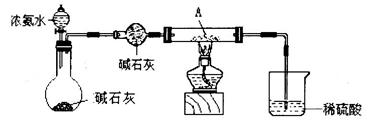
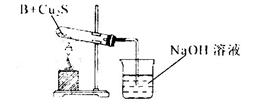
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
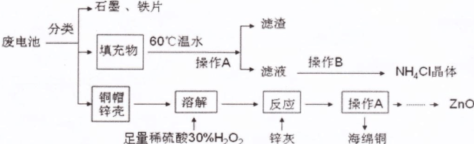
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com