
根据以下几个反应:
①Cl2+2KI=2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2FeCl3+2KI=2FeCl2+2KCl+I2
④I2+SO2+2H2O=H2SO4+2HI
判断氧化性由强到弱的顺序是()
A. Cl2>I2>Fe3+>SO2 B. Cl2>Fe3+>I2>SO2
C. Cl2>Fe3+>SO2>I2 D. Fe3+>I2>Cl2>SO2
考点: 氧化性、还原性强弱的比较.
专题: 氧化还原反应专题.
分析: 根据反应中元素化合价的降低来分析氧化剂,然后利用氧化剂的氧化性大于氧化产物的氧化性来比较.
解答: 解:反应①中Cl元素的化合价由0降低为﹣1价,则Cl2为氧化剂,由氧化剂的氧化性大于氧化产物的氧化性,则氧化性Cl2>I2,
反应②中Cl元素的化合价由0降低为﹣1价,则Cl2为氧化剂,由氧化剂的氧化性大于氧化产物的氧化性,则氧化性Cl2>Fe3+,
反应③中Fe元素的化合价由+3价降低为+2价,则氯化铁为氧化剂,由氧化剂的氧化性大于氧化产物的氧化性,则氧化性Fe3+>I2,
反应④中I元素的化合价由0降低为﹣1价,则I2为氧化剂,由氧化剂的氧化性大于还原剂的氧化性,则氧化性I2>SO2,
由以上反应可知氧化性强弱为Cl2>Fe3+>I2>SO2,
故选B.
点评: 本题考查氧化性的比较,明确氧化还原反应中元素的化合价变化及氧化剂的氧化性大于氧化产物的氧化性是解答本题的关键.


科目:高中化学 来源: 题型:
在某无色透明的酸性溶液中,能共存的离子组是()
A. Na+、K+、SO42﹣、HCO3﹣ B. Cu2+、K+、SO42﹣、NO3﹣
C. Na+、K+、Cl﹣、NO3﹣ D. Fe3+、K+、SO42﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
两种气态烃组成的混合气体0.1mol,完全燃烧得到0.16molCO2和3.6g水,下列说法错误的是()
A. 混合气体中一定有甲烷
B. 混合气体中一定是甲烷和乙烷
C. 混合气体中一定没有乙烷
D. 混合气体中一定没有乙炔(C2H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积相同的三个容器里分别充入三种气体①氢气;②二氧化碳;③氧气,并保持三个容器内气体的温度和密度均相等,下列说法正确的是()
A. 分子数目:①=②=③ B. 质量关系:①<③<②
C. 压强关系:①>③>② D. 原子数目:②>③>①
查看答案和解析>>
科目:高中化学 来源: 题型:
等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合,离子方程式正确的是()
A. HCO3﹣+OH﹣→H2O+CO32﹣
B. 2 HCO3﹣+Ba(OH)2→BaCO3↓+2H2O+CO32
C. HCO3﹣+Ba2++OH﹣→BaCO3↓+H2O
D. 2 HCO3﹣+Ba2++2OH﹣→BaCO3↓+2H2O+CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
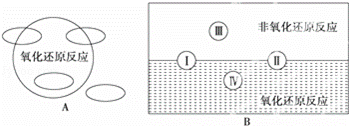
(1)①A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:H2+CuO═Cu+H2O所属的区域是 .
.
②“四种基本反应类型与氧化还原反应的关系”也可用B图表达.其中Ⅰ为化合反应,则Ⅱ为分解反应.写出有水生成的符合反应类型Ⅲ的一个化学方程式: .写出有水参加的符合反应类型Ⅳ的一个化学方程式: ,其中水为 剂.
(2)已知反应:①SO3+H2O═H2SO4
②Cl2+H2O═HCl+HClO
③2F2+2H2O═4HF+O2
④2Na+2H2O═2NaOH+H2↑
⑤2Na2O2+2H2O═4NaOH+O2↑
⑥SiO2+2NaOH═Na2SiO3+H2O
上述反应中不属于氧化还原反应的有 (填序号,下同);H2O被氧化的是 ,H2O被还原的是 ,属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是 .
(3)反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,
Mn元素的化合价由 价变为 价,被 ;Cl元素的原子失去电子,被 ;若参加反应的HCl是73g,则被氧化的HCl是 g.
(4)根据反应①2FeCl3+2KI═2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列原子或离子原子核外电子排布不属于基态排布的是( )
|
| A. | N:1s22s22p3 | B. | S2﹣:1s22s22p63s23p6 |
|
| C. | Na:1s22s22p53s2 | D. | Si:1s22s22p63s23p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氧是地壳中含量最多的元素.
(1)氧元素基态原子核外未成对电子数为 个.
(2)H2O分子内的O﹣H键、分子间的范德华力和氢键从强到弱依次为 . 的沸点比
的沸点比 高,原因是 .
高,原因是 .
(3)H+可与H2O形成H3O+,H3O+原子采用 杂化.H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,原因为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极 Pb+SO42﹣═PbSO4+2e﹣
正极 PbO2+4H++SO42﹣+2e﹣═PbSO4+2H2O
今若制得Cl2 0.050摩,这时电池内消耗的H2SO4的物质的量至少是()
A. 0.025摩 B. 0.050摩 C. 0.10摩 D. 0.20摩
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com