
 CH2 = CH2 ↑+ NaCl +H2O 消去反应
CH2 = CH2 ↑+ NaCl +H2O 消去反应 CH2BrCH2Br 加成反应
CH2BrCH2Br 加成反应 HOCH2CH2OH + 2NaBr 取代反应
HOCH2CH2OH + 2NaBr 取代反应

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源:不详 题型:填空题

| 实验次数 | 酸的温度 | 碱的温度 | 反应最高温度 |
| 1 | 21.5℃ | 20.5℃ | 24.3℃ |
| 2 | 21.5℃ | 21.5℃ | 25.0℃ |
| 3 | 16.0℃ | 18.5℃ | 21.5℃ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2、O2、N2 | B.HCl、Cl2、CO2 | C.CH4、H2、CO | D.SO2、Cl2、O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
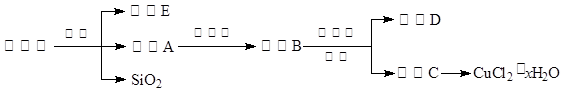
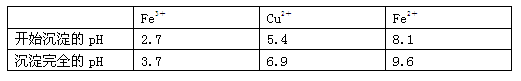
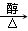
| A.氨水 | B.氧化铜 | C.氢氧化铜 | D.氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
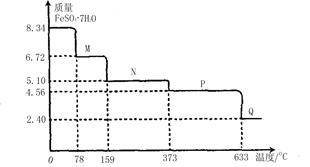
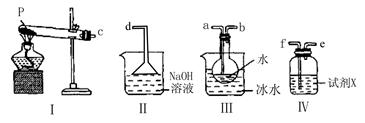
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

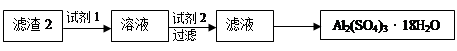
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
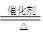 4NO+6H2O。请从下图中选用所需的仪器(可重复使用)组成一套进行该反应的简单装置。现提供试剂:过氧化钠、碱石灰、铂粉、氯化钙、浓硫酸、浓氨水和氢氧化钠溶液。
4NO+6H2O。请从下图中选用所需的仪器(可重复使用)组成一套进行该反应的简单装置。现提供试剂:过氧化钠、碱石灰、铂粉、氯化钙、浓硫酸、浓氨水和氢氧化钠溶液。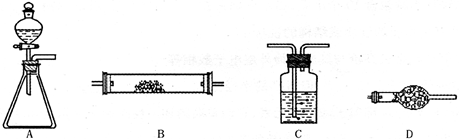
| 选用的仪器(填字母) | 加入的试剂 | 作用 |
| | | |
| | | |
| | | |
| | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com