
【题目】某氮肥厂氨氮废水中的氮元素多以NH4+和NH3![]() H2O的形式存在,该废水的处理流程如下:
H2O的形式存在,该废水的处理流程如下:
![]()
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。
①用离子方程式表示加NaOH溶液的作用:____________。
②用化学平衡原理解释通空气的目的:__________。
(2) 过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
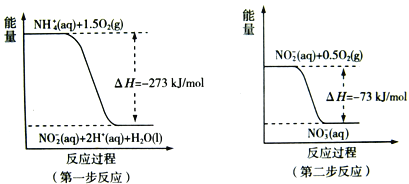
①第一步反应是_________反应(选题“放热”或“吸热”),判断依据是__________。
②1mol NH4+(aq)全部氧化成![]() 的热化学方程式是______________。
的热化学方程式是______________。
(3) 过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗![]() 转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是__________。
转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是__________。
【答案】![]()
![]()
![]() 废水中的NH3被空气带走,使
废水中的NH3被空气带走,使![]() D的平衡向正反应方向移动,利于除氨 放热
D的平衡向正反应方向移动,利于除氨 放热 ![]() H=-273kJ/mol<0(反应为的总能量大于生成物的总能量)
H=-273kJ/mol<0(反应为的总能量大于生成物的总能量) ![]()
![]()
![]()
![]() H=-346kJ/mol 5:6
H=-346kJ/mol 5:6
【解析】
(1)①铵根能和强碱反应生成一水合氨;②减少生成物,可以使化学平衡向正反应方向移动;
(2)①当反应物的总能量大于生成物的总能量,反应是放热的;
②结合图象根据盖斯定律来计算反应的焓变;
(3)根据得失电子守恒来解题。
(1)①铵盐能和强碱反应,实质是:NH4++OH-═NH3![]() H2O,故答案为:NH4++OH-═NH3
H2O,故答案为:NH4++OH-═NH3![]() H2O;
H2O;
②氨水电离是可逆反应,将生成的氨气带走,即减少生成物,可以使化学平衡向正反应方向移动,即更多的生成氨气,因而促进了氨水电离,故答案为:空气可以将生成的氨气带走,使化学平衡向正反应方向移动,促进了氨水电离;
(2)①焓变小于0,则反应为放热反应,故答案为:放热;因为![]() H=-273kJ/mol<0(反应物的总能量大于生成物的总能量);
H=-273kJ/mol<0(反应物的总能量大于生成物的总能量);
②第一步的热化学方程式为NH4+(aq)+1.5O2(g)═NO2-(aq)+2H+(aq)+H2O(l),![]() H=-273kJ/mol,第二步的热化学方程式为:NO2-(aq)+0.5O2(g)═NO3-(aq),
H=-273kJ/mol,第二步的热化学方程式为:NO2-(aq)+0.5O2(g)═NO3-(aq),![]() H=-73kJ/mol,根据盖斯定律则NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),
H=-73kJ/mol,根据盖斯定律则NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),![]() H=-346 kJ/mol,故答案为:NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),
H=-346 kJ/mol,故答案为:NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),![]() H=-346 kJ/mol;
H=-346 kJ/mol;
(3)32gCH3OH(相当于1mol甲醇)作还原剂,失去6mol电子,这样得到6mol电子需要1.2mol硝酸做氧化剂(注:1mol硝酸变成N2需要得到5mol电子),因此参加反应的还原剂和氧化剂的物质的量之比是5:6。故答案为:5:6。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是_____________________。
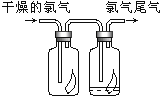
(2)为防止氯气尾气污染空气,实验室通常用______溶液吸收多余的氯气,原理是__________________。
(用化学方程式表示)。
根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是______(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是______(填字母,下同)。
A.O2 B.Cl2 C.CO2 D.HClO
(3)一旦发生氯气泄漏和爆炸事故,周围群众应紧急疏散。当人们逃离爆炸现场时,可以用浸有一定浓度某物质水溶液的毛巾捂住鼻子,最适宜采用的该物质是_____________。
A.NaOH B.NaCl C.KCl D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前手机屏幕主要由保护玻璃、触控层以及下面的液晶显示屏三部分组成。下面是工业上用丙烯(A)和有机物C(C7H6O3)为原料合成液晶显示器材料(F)的主要流程:

(1)化合物C的官能团名称为____________________。B的结构简式为_____________。
(2)反应①的反应类型为_____________。
(3)写出C与过量NaHCO3水溶液反应的化学方程式______________________________。
(4)下列关于化合物D的说法正确的是__________(填字母)。
A.属于烯烃B.1molD最多能与4molH2发生加成反应
C.一定条件下发生缩聚反应D.核磁共振氢谱有6组峰
(5)满足下列条件下的D的同分异构体有多种,写出2个互为顺反异构的结构简式。顺式结构:_______________,反式结构_______________。
①能发生银镜反应和水解反应②存在手性碳原子
(6)请参照上述制备流程,写出以有机物C、乙烯和![]() 为原料制备
为原料制备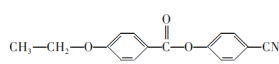 的合成路线流程图(无机试剂任用)___。
的合成路线流程图(无机试剂任用)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知CH3OH(g)+![]() O2(g) CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是________(填字母)。
O2(g) CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是________(填字母)。

a.CH3OH转变成H2的过程是一个吸收能量的过程
b.H2的生成速率与CH3OH的消耗速率之比为1∶2
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.1 mol H—O键断裂的同时2 mol C=O键断裂,则反应达最大限度
(2)某温度下,将5 mol CH3OH和2 mol O2充入2 L的密闭容器中,经过4 min反应达到平衡,测得c(O2)=0.2 mol·L-1,4 min内平均反应速率v(H2)=________,则CH3OH的转化率为_______________。
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。则下列说法正确的是________(填序号)。
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4 g CH3OH转移1.2 mol电子
(4)写出CH3OH燃料电池在酸性条件下负极的反应式______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A. 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B. 由C(石墨)=C(金刚石)ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定
C. 在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)![]() 2H2O(l) ΔH=+285.8 kJ·mol-1
2H2O(l) ΔH=+285.8 kJ·mol-1
D. 在稀溶液中:H++OH-![]() H2O ΔH=-57.3 kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3 kJ
H2O ΔH=-57.3 kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:
①2H2(g)+O2(g)===2H2O(l) ΔH=-570 kJ·mol-1;
②H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1;
③C(s)+1/2O2(g)===CO(g) ΔH=-110.5 kJ·mol-1;
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1;
⑤CO2(g)+2H2O(g)===2CH4(g)+2O2(g) ΔH=+890 kJ·mol-1
回答下列问题:
(1)上述反应中属于吸热反应的___________________________________________。
(2)H2的燃烧热为_______________________________________________________。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s)+H2O(g)===H2(g)+CO(g) ΔH=a kJ·mol-1;则a=________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某恒温恒容的密闭容器内发生反应:2A(g)+B(g)![]() C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
A. 再充入2mol A,平衡正移,A的转化率增大
B. 如果升高温度,C的体积分数增大
C. 如果增大压强,化学平衡一定向正反应方向移动,B的体积分数减小
D. 再充入1mol C,C的物质的量浓度将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变大B. 平衡向正反应方向移动
C. D的体积分数变大D. a<c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应原理判断正确的是( )
A.若一定条件下,反应![]() 达平衡后,压缩容器,则反应物浓度增大,平衡正向移动
达平衡后,压缩容器,则反应物浓度增大,平衡正向移动
B.已知水合肼(![]() )是二元弱碱,能发生类似于多元酸的电离形式,则在水中它的第二步电离方程式为
)是二元弱碱,能发生类似于多元酸的电离形式,则在水中它的第二步电离方程式为![]()
C.同温同压下,![]() 在光照和点燃条件下的
在光照和点燃条件下的![]() 不同
不同
D.在一定条件下的![]() 溶液,若升高温度,则
溶液,若升高温度,则![]() 减小
减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com