
| A、20℃时,密度小于1.174 g/cm3的KCl溶液也可能是饱和溶液 | ||
B、此溶液中KCl的质量分数为
| ||
| C、25℃时,饱和KCl溶液的浓度大于4.0 mol/L | ||
| D、将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g/cm3 |
| 1000ρω |
| M |
| 1000ρω |
| M |
| 4×74.5 |
| 1000×1.174 |


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
| A、离子化合物中一定存在离子键 |
| B、单质分子中均存在非极性键 |
| C、一种金属元素和一种非金属元素组成的化合物中不可能含共价键 |
| D、含有极性键的物质一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
3 2 |
3 2 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱性:KOH>NaOH |
| B、相对原子质量:Ar>K |
| C、酸性:HClO4>H2SO4 |
| D、元素的金属性:Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学键是一种作用力 |
| B、非极性键不是化学键 |
| C、化学反应过程中,反应物内的化学键断裂,产物中的化学键形成 |
| D、化学键可以使离子相结合,也可以使原子相结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子晶体在熔化时,离子键被破坏,而分子晶体熔化时化学键不被破坏 |
| B、白磷晶体中,结构粒子之间通过共价键结合 |
| C、石英晶体是直接由硅原子和氧原子通过共价键所形成的空间网状结构的晶体 |
| D、构成分子晶体的结构粒子中不一定存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳氢键断裂的位置相同 |
| B、碳溴键断裂的位置相同 |
| C、产物相同,反应类型相同 |
| D、产物不同,反应类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
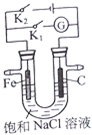
| A、K1闭合,铁棒上发生的反应为2H++2e→H2↑ |
| B、K1闭合,石墨棒周围溶液pH逐渐升高 |
| C、K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D、K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com