
| A. | 天然植物油常温下一般呈液态,难溶于水,没有恒定的熔点、沸点 | |
| B. | 乙醛、乙酸和葡萄糖都能与新制的Cu(OH)2反应,且反应类型均为氧化反应 | |
| C. | 乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
分析 A.天然植物油为混合物,成分为酯类物质;
B.乙酸与氢氧化铜发生中和反应,乙醛、葡萄糖含-CHO;
C.乙醛可以制取聚乙醛等、氯乙烯可以合成聚氯乙烯,乙二醇可以和乙二酸缩聚;
D.石油裂化提高汽油的含量,裂解得到小分子烯烃.
解答 解:A.天然植物油为混合物,成分为酯类物质,则常温下一般呈液态,难溶于水,没有恒定的熔点、沸点,故A正确;
B.乙酸与氢氧化铜发生中和反应,乙醛、葡萄糖含-CHO,与氢氧化铜发生氧化反应,故B错误;
C.乙醛可以制取聚乙醛等、氯乙烯可以合成聚氯乙烯,乙二醇可以和乙二酸缩聚,则乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体,故C正确;
D.石油裂化提高汽油的含量,裂解得到小分子烯烃,即石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃,故D正确;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的组成、性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意石油的综合利用,题目难度不大.


科目:高中化学 来源: 题型:解答题

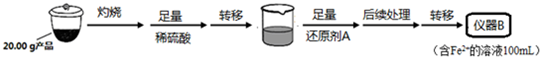
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当混合气体的质量不变,说明反应已达到平衡状态 | |
| B. | 缩小容器体积,重新达到平衡时,气体平均相对分子质量不变或增大 | |
| C. | 在恒压容器中升高温度,气体混合物中C%可能先增大后减小 | |
| D. | 在恒容容器中升高温度,达到新平衡时,气体的密度可能增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 缩小容器体积,NO2体积分数减小,混合气体颜色变浅 | |
| B. | 保持容器体积不变,加入少许NO2,重新达到平衡时,NO2的体积分数增大 | |
| C. | 保持容器体积不变,加入少许N2O4再达到平衡时,气体颜色变深 | |
| D. | 保持容器体积不变,加入少许NO2,将使正反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
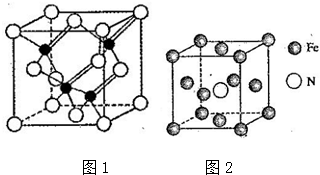
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合气体的密度不随时间变化而变化 | |
| B. | 3v正(B)=v逆(D) | |
| C. | D的物质的量分数在混合气体中保持不变 | |
| D. | B、C、D的分子个数之比为3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
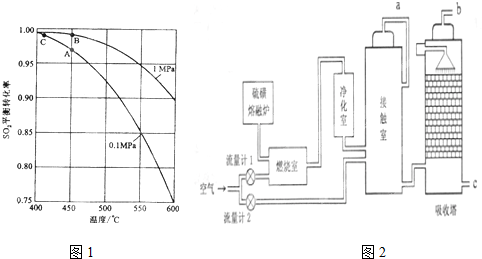
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com