


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
| A、氧化还原反应必然有氧元素的得失 |
| B、置换反应一定属于氧化还原反应 |
| C、某元素在化学反应中由化合态变为游离态,该元素可能被氧化,也可能被还原 |
| D、失电子越多还原性越强,得电子越多氧化性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下2.24LCO2通入1mol?L-1100mL氢氧化钠溶液中:CO2+OH-=HCO3- |
| B、硝酸铝溶液中加入过量氨水:Al3-+4NH3?H2O=AlO2-+4 NH4++2H2O |
| C、Na2S水解:S2-+2 H2O?H2S+2OH- |
| D、等物质的量的NH4HCO3与NaOH在溶液中反应:NH4++HCO3-+2OH-=CO32-+NH3↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠与水反应2O22-+2H2O=4OH-+O2↑ |
| B、铝与氢氧化钠溶液反应Al+OH-+H2O=AlO2-+H2↑ |
| C、硫酸铝和氨水反应Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| D、氯气与氢氧化钠溶液反应Cl2+2OH-=Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度(mol/L) | 0.1 | 0.2 | 0 |
| 平衡浓度(mol/L) | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,X的转化率为50% |
| B、反应可表示为X(g)+3Y(g)?2Z(g) |
| C、增大压强可使平衡向生成Z的方向移动,平衡常数增大 |
| D、改变温度可以改变此反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
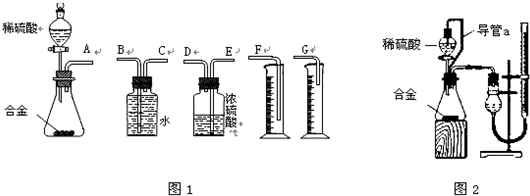
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
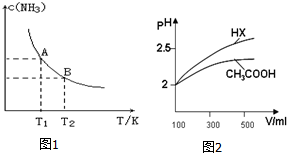 (1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g).若已知:
(1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g).若已知:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com