
【题目】(16分)下图中的实验装置可用于制取乙炔。请填空:

(1)图中,A管的作用是 。
制取乙炔的化学方程式是 。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是 ,乙炔发生了 反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是 ,乙炔发生了 反应。
(4)为了安全,点燃乙炔前应 ,乙炔燃烧时的实验现象是 。
【答案】(1)调节水面高度以控制反应的发生和停止 CaC2+2H2O―→Ca(OH)2+C2H2↑
(2)KMnO4溶液退色 氧化
(3)溴的CCl4的溶液退色 加成
(4)检验乙炔的纯度 火焰明亮并伴有浓烈的黑烟
【解析】
(1)因为电石与水很剧烈,反应不易控制,所以通过调节水面高度以控制反应的发生与停止,方程式为CaC2+2H2O →C2H2↑+ Ca(OH)2。
(2)乙炔中含有碳碳三键,容易被氧化,所以乙炔可以使酸性高锰酸钾溶液褪色。
(3)同样因为乙炔中含有碳碳三键,容易发生加成反应,所以乙炔可以使溴的CCl4溶液褪色。
(4)乙炔实验可燃性气体,点燃前需要检验其纯度。防止燃烧时爆炸。乙炔中含碳量很高,燃烧时火焰明亮并伴有浓烈黑烟。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】下列溶液中粒子的物质的量浓度关系正确的是( )
A. 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO![]() )>c(HCO
)>c(HCO![]() )>c(OH-)
)>c(OH-)
B. 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C. 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH![]() )+c(OH-)
)+c(OH-)
D. 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中: c(OH-)>c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组拟取苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等)来制取较纯净的氯化钾晶体及液溴,设计了如下流程:

回答以下问题:
(1)操作I的名称是__________________。从橙色液体中分离出溴,所采取的操作需要的主要玻璃仪器除酒精灯、温度计、锥形瓶外,还需要
_________________________。
(2)试剂z的化学式为_____________;检验SO42-已除尽的方法是_____________________________。
(3)无色溶液B中加入稀盐酸至溶液呈酸性,发生反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为元素周期表的一部分,其中X、Y、Z、W为四种短周期元素。Z元素原子核外K层与M层上的电子数相等,W元素的主族序数和周期数相同。下列说法中正确的是( )
![]()
A. Y元素的最高价氧化物对应的水化物的化学式为H3YO4
B. Y的最简单气态氢化物的水溶液显弱碱性
C. 原子半径由小到大的顺序为X<Z<Y<W
D. X、Z两种元素的氧化物中所含化学键的类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,经测定Fe3+、SO42-、Al3+和M离子的物质的量之比为2∶4∶1∶1,则M离子可能是下列中的( )
A.Na+B.OH-
C.S2-D.Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列说法正确的是( )
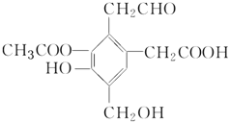
A. 1mol该物质可以和4molNaOH反应
B. 分子中含有六种官能团
C. 可发生加成反应、中和反应、水解反应、酯化反应、氧化反应和消去反应
D. 在水溶液中该有机物中的羟基和羧基均能电离出氢离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C5H10O2的有机物R在酸性条件下可水解为酸和醇,下列说法不正确的是
A.这些醇和酸重新组合可形成的酯共有40种
B.分子式与R相同的酸与足量碱石灰共热,最多可得到2种烷烃
C.R水解得到的酸至少有5对共用电子对数目
D.R水解得到的醇发生消去反应,可得到4种烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我们的日常生活中出现了“加碘食盐”“铁强化酱油”“高钙牛奶”“含氟牙膏”等商品。这里的碘、铁、钙、氟应理解为
A.元素B.单质C.分子D.氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.60gCuSO4固体置于下图所示的装置(固定及夹持类仪器未画出)中加热到1100℃,使其分解,分解过程中可以观察到:石英管中固体由白色变为黑色,最终变为红色;BaCl2溶液中生成白色沉淀,品红溶液褪色,集气瓶中收集到无色气体。
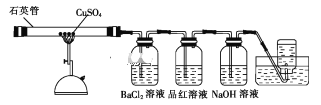
(1)石英主要成分的化学式是_____;高温分解CuSO4固体使用石英管而不使用普通玻璃管的原因是_____。
(2)石英管中剩余红色固体质量为0.72 g,经检测为不含硫元素的纯净物。则该固体的化学式为__。
(3)将BaCl2溶液中生成的白色沉淀过滤并洗涤,向洗涤后的沉淀中加入稀盐酸,无明显现象。
①沉淀的化学式为_____。
②检验沉淀是否洗净的方法是___。
(4)若NaOH溶液足量,则其中发生反应的离子方程式为____。
(5)集气瓶中收集的无色气体是____(填化学式),检验该气体的方法是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com