
【题目】在标准状况下进行甲、乙、丙三组实验。三组实验各取同浓度的盐酸30mL,加入同一种镁铝合金粉末,产生气体。有关数据列表如下(气体体积均为标准状况下测得):
实验序号 | 甲 | 乙 | 丙 |
合金质量/g | 0.255 | 0.385 | 0.459 |
生成气体/ml | 280 | 336 | 336 |
(1)该盐酸的物质的量浓度____________;
(2)合金中Mg、Al的物质的量之比为___________;
(3)在丙组实验后,向容器中加入1mol/L的NaOH溶液,恰好使合金中的铝元素全部转化为AlO2-,并使Mg2+刚好沉淀完全,则溶液中AlO2-的物质的量为__________mol;溶液中Na+的物质的量为_________mol;所加NaOH溶液的体积为_________mL。
【答案】1mol/L 1:1 0.009 0.039 39
【解析】
结合表格数据,盐酸浓、体积一定,甲中合金质量小于乙中合金质量,且甲中生成气体体积小于乙中气体体积,说明甲中盐酸过量、金属完全反应,乙中合金质量小于丙中合金质量,且乙、丙生成气体体积相等,说明乙、丙中盐酸完全反应,生成336mL氢气需要金属的质量为0.255g×![]() =0.306g,故乙中金属剩余,盐酸不足;
=0.306g,故乙中金属剩余,盐酸不足;
(1)盐酸完全反应生成氢气336mL,根据n=![]() 计算氢气的物质的量,根据氢元素守恒可知n(HCl)=2n(H2),据此计算;
计算氢气的物质的量,根据氢元素守恒可知n(HCl)=2n(H2),据此计算;
(2)甲中盐酸有剩余,金属完全反应,此时生成氢气280mL,故可以根据甲组数据计算金属的物质的量之比,令镁、铝的物质的量分别为xmol、ymol,根据二者质量之和与电子转移守恒列方程计算x、y的值,据此解答;
(3)丙实验之后,向容器中加入NaOH溶液,恰好使合金中的铝元素全部转化为AlO2-,并使Mg2+刚好沉淀完全,反应后溶液中溶质为氯化钠、偏铝酸钠.由(2)中计算Mg、Al的物质的量可知丙中Al的物质的量,根据铝元素守恒计算偏铝酸钠的物质的量,根据氯离子守恒计算溶液中n(NaCl)=n(HCl),根据钠离子守恒可知n(NaOH)=n(NaCl)+n(NaAlO2),n(Na+)=n(NaOH),再根据V=![]() 计算氢氧化钠的体积。
计算氢氧化钠的体积。
(1)盐酸完全反应生成氢气336mL,氢气的物质的量为![]() =0.015mol,根据氢元素守恒可知n(HCl)=2n(H2)=2×0.015mol=0.03mol,故盐酸的物质的量浓度为
=0.015mol,根据氢元素守恒可知n(HCl)=2n(H2)=2×0.015mol=0.03mol,故盐酸的物质的量浓度为![]() =1mol/L;
=1mol/L;
(2)甲中盐酸有剩余,金属完全反应,此时生成氢气280mL,故可以根据甲组数据计算金属的物质的量之比,令镁、铝的物质的量分别为xmol、ymol,根据二者质量可知24x+27y=0.255,根据电子转移守恒有2x+3y=![]() ×2,联立方程解得:x=0.005、y=0.005,故合金中镁与铝的物质的量之比为0.005mol:0.005mol=1:1;
×2,联立方程解得:x=0.005、y=0.005,故合金中镁与铝的物质的量之比为0.005mol:0.005mol=1:1;
(3)丙实验之后,向容器中加入NaOH溶液,恰好使合金中的铝元素全部转化为AlO2,并使Mg2+刚好沉淀完全,反应后溶液中溶质为氯化钠、偏铝酸钠,由(2)中计算Mg、Al的物质的量可知丙中Al的物质的量为0.005mol×![]() =0.009mol,根据铝元素守恒可知n(NaAlO2)=n(Al原子)=0.009mol,根据氯离子守恒可知n(NaCl)=1mol/L×0.03L=0.03mol,根据钠离子守恒可知n(NaOH)=n(NaCl)+n(NaAlO2)=0.03mol+0.009mol=0.039mol,n(Na+)=n(NaOH)=0.039mol,故需要氢氧化钠溶液的体积为
=0.009mol,根据铝元素守恒可知n(NaAlO2)=n(Al原子)=0.009mol,根据氯离子守恒可知n(NaCl)=1mol/L×0.03L=0.03mol,根据钠离子守恒可知n(NaOH)=n(NaCl)+n(NaAlO2)=0.03mol+0.009mol=0.039mol,n(Na+)=n(NaOH)=0.039mol,故需要氢氧化钠溶液的体积为![]() =0.039L=39mL。
=0.039L=39mL。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 31 g白磷(![]() )含有共价键的总数为1.5NA
)含有共价键的总数为1.5NA
B. 常温下,22.4 mL H2O中所含氢氧键的数目约为2.49NA
C. 8.7 g MnO2与40 mL 10 mol·L-1的浓盐酸充分反应,生成的氯气分子数为0.1NA
D. 常温下,1 L pH=11的Na2CO3溶液中由水电离出的H+数目为0.001NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟的单质及其化合物在生产杀虫剂、灭火剂及特种塑料等方面用途广泛。
(1)在2%的氢氧化钠溶液中通入氟气,发生反应:2F2+2NaOH═2NaF+H2O+OF2。该反应氧化剂与还原剂的物质的量之比为____,OF2的电子式为___。
(2)SF6是一种优良的绝缘气体材料,分子结构中只存在S-F键,已知1molS(s)转化为气态硫原子时吸收能量280kJ,形成1molF-F、S-F键需放出的能量分别为160kJ、330kJ,试写出固态S单质和氟气反应生成SF6气体的热化学方程式______。
(3)用含氟牙膏刷牙,氟离子会与牙釉质[主要成分为Ca5(PO4)3OH]发生反应: Ca5(PO4)3OH(s)+F-(aq)![]() Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=_____(已知Ksp[Ca5(PO4)3OH]=7×l0-37,Ksp[Ca5(PO4)3F]=2.8×l0-61)。
Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=_____(已知Ksp[Ca5(PO4)3OH]=7×l0-37,Ksp[Ca5(PO4)3F]=2.8×l0-61)。
(4)聚四氟化烯常用于炊具的“不粘涂层”。制备四氟化烯的反应原理为:2CHClF2(g)![]() C2F4(g)+2HCl(g)△H1(反应I),副反应为:3CHClF(g)
C2F4(g)+2HCl(g)△H1(反应I),副反应为:3CHClF(g)![]() C3F6(g)+3HCl(g)△H2(反应II),反应达到平衡时各气体的物质的量分数随温度的变化如图所示:
C3F6(g)+3HCl(g)△H2(反应II),反应达到平衡时各气体的物质的量分数随温度的变化如图所示:

① 在恒温恒容的条件下,下列能够说明反应I达到化学平衡状态的是:_________(填标号)。
A.混合气体密度不再改变 B.混合气体平均相对分子质量不再改变
C.v正(C2F4)=2V逆(HCl) D.c(C2F4)与c(HCl)比值保持不变
② 图中曲线A表示的物质是:______(填化学式)。
③反应2CHClF2(g)![]() C2F4(g)+2HCl(g)的△H_____0(填“>”或“<”)。
C2F4(g)+2HCl(g)的△H_____0(填“>”或“<”)。
④工业上常在900℃以上通过裂解CHClF2来制取C2F4,其原因是______。
(5)25℃时,向amol/L的NaF溶液中滴加等体积bmol/L的盐酸使溶液呈中性(不考虑盐酸与氢氟酸的挥发,忽略溶液体积变化),则HF的电离平衡常数Ka=______。(用含a和b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.用水稀释0.1mol·L-1的氨水,则溶液中![]() 增大
增大
B.化学反应的反应热只与反应途径有关,而与反应体系的始态和终态无关
C.在等体积等pH的盐酸和醋酸两溶液中分别加入等质量的相同锌粒,若只有一种溶液中的锌粒有剩余,则该溶液一定是盐酸
D.两种氨水的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c2=10c1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):

下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定石灰石样品中碳酸钙的质量分数,某学习小组进行了如下实验探究,取10g石灰石样品放入烧杯中,加入稀盐酸至不再产生气泡为止(石灰石中的杂质不溶于水,也不反应),并绘制了加入稀盐酸的质量与放出气体质量的坐标图(见图)。

(1)碳酸钙完全反应用去稀盐酸的质量为__________g。
(2)该石灰石样品中碳酸钙的质量分数为_________。
(3)当盐酸和石灰石恰好完全反应,所得溶液中溶质质量分数是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某石灰石中CaCO3的质量分数,称取W g石灰石样品,加入过量的浓度为6 mol/L的盐酸,使它完全溶解,加热煮沸,除去溶解的CO2,再加入足量的草酸铵[(NH4)2C2O4]溶液后,慢慢加入氨水降低溶液的酸度,则析出草酸钙沉淀,离子方程式为:C2O42-+Ca2+=CaC2O4↓,过滤出CaC2O4后,用稀硫酸溶解:CaC2O4+H2SO4=H2C2O4+CaSO4,再用蒸馏水稀释溶液至V0mL。取出V1mL用a mol/L的KMnO4酸性溶液滴定,此时发生反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,若滴定终点时消耗a mol/L的KMnO4V2mL,样品中CaCO3的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第五主族的磷单质及其化合物在工业上有广泛应用.
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)═3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)═6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)═P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)═CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,则△H=______;
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子产物,其结构式为______,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为______;
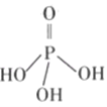
(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍.
①化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性等条件下发生下述反应:
(a) Ni2++ H2PO2﹣+ → Ni++ H2PO3﹣+
(b)6H2PO﹣2+2H+═2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a) ___________________________;
②利用①中反应可在塑料镀件表面沉积镍﹣磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀.请从以下方面比较化学镀与电镀.
方法上的不同点:______;
原理上的不同点:______;
化学镀的优点:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023
B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7
C.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
D.一定条件下反应N2+3H2![]() 2NH3达到平衡时,3v正(H2)=2v逆(NH3)
2NH3达到平衡时,3v正(H2)=2v逆(NH3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com