
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 ( )
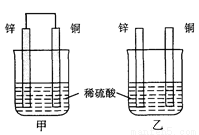
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
实验室要配制0.5 mol/L硫酸溶液500 mL,需要用10 mol/L的硫酸溶液的体积是( )
A.25 B.25 L C.25 mL D. 50 mL
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上教学质检化学试卷(解析版) 题型:选择题
下列实验方案设计中,可行的是
A. 加稀盐酸后过滤,除出去混在铜粉中的少量镁粉和铝粉
B. 用萃取的方法分离汽油和煤油
C. 用溶解、过滤的方法分离KNO3和NaCl固体的混合物
D. 将O2和H2的混合物通过灼热的氧化铜,以除去其中的H2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上教学质检化学试卷(解析版) 题型:选择题
下列表达方式错误的是
A. D2O分子中氧原子为sp3杂化
B. Cr原子价电子排布式:3d54s1
C. 硫离子的核外电子排布式:1s22s22p63s23p6
D. S原子的电子排布图: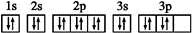
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:填空题
Ⅰ在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如
CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如 下图:
下图: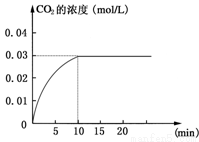
(1)根据上图数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)= mol/(L·min);反应达平衡时,c(H2)=________ mol/L,该温度下的平衡常数K 。
(2) 判断该反应达到平衡的依据是________________。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为零
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同的条件下,反应达平衡时,c(H2O)=_____________mol/L。
Ⅱ、在含有I-、Cl-的混合溶液中,逐滴加入一定量AgNO3溶液,当AgCl开始沉淀时,溶液中 为:___________,已知Ksp(
为:___________,已知Ksp( AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
不能说明反应P(g)+Q(g) R(g)+S(s)在恒温、恒容下已达到平衡的是( )
R(g)+S(s)在恒温、恒容下已达到平衡的是( )
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
某金属能和盐酸反应生成氢气,与锌组成原电池时,锌为负极,则该金属可能为( )
A.铝 B.铜 C.锡 D.硅
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究氧化物与悬浮在大气中的海盐粒子的相互作用时,设计如下反应:
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,设计如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列说法正确的是( )
下列说法正确的是( )| A. | FeO、Fe2O3和Fe3O4均为黑色固体 | |
| B. | 反应②③互为可逆反应 | |
| C. | 热稳定性顺序为:FeO>Fe2O3>Fe3O4 | |
| D. | 四氧化三铁中铁元素的化合价复杂,若写成氧化物的形式则化学式可写为FeO•Fe2O3,若视四氧化三铁为一种盐其化学式可写为Fe(FeO2)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com