【答案】
分析:(1)Fe
3+遇KSCN溶液显红色,该现象用于检验Fe
3+存在,可以加入氧化剂将Fe
2+氧化为Fe
3+.检验Fe
2+可以先滴加KSCN溶液,溶液不变色,再滴加氯水或双氧水,溶液变为血红色,说明含有Fe
2+;
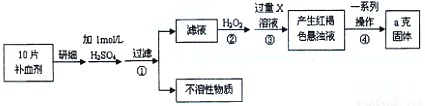
(2)由流程图可知,该实验原理为:将药品中的Fe
2+形成溶液,将Fe
2+氧化为Fe
3+,使Fe
3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.步骤②加入过量H
2O
2的是将Fe
2+氧化为Fe
3+;
(3)步骤③是将Fe
3+转化为氢氧化铁沉淀,试剂X可以是氢氧化钠或氨水等;
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(5)根据氧化铁的质量计算铁元素的质量.注意ag氧化铁含有的铁元素质量为10片含有的铁元素质量;
(6)①精确配制一定物质的量浓度的KMnO
4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶;
②KMnO
4溶液需要酸化,用于酸化的酸不能具有强氧化性氧化Fe
2+,不能具有强还原性被高锰酸钾氧化,否则会影响高锰酸钾溶液的体积;
③高锰酸钾为紫色,当滴定到终点时,Fe
2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色.
解答:解:(1)Fe
3+遇KSCN溶液显红色,该现象用于检验Fe
3+存在,可以加入氧化剂将Fe
2+氧化为Fe
3+.检验Fe
2+可以先滴加KSCN溶液,溶液不变色,再滴加氯水或双氧水,溶液变为血红色,说明含有Fe
2+,故答案为:氯水或双氧水;溶液由浅绿色变成血红色;
(2)由流程图可知,该实验原理为:将药品中的Fe
2+形成溶液,将Fe
2+氧化为Fe
3+,使Fe
3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.步骤②加入过量H
2O
2的是将Fe
2+氧化为Fe
3+,故答案为:将Fe
2+全部氧化成Fe
3+;
(3)步骤③是将Fe
3+转化为氢氧化铁沉淀,试剂X可以是氢氧化钠或氨水等,反应离子方程式为Fe
3++3OH
-=Fe(OH)
3↓(或Fe
3++3NH
3?H
2O=Fe(OH)
3↓+3NH
4+ ),
故答案为:Fe
3++3OH
-=Fe(OH)
3↓(或Fe
3++3NH
3?H
2O=Fe(OH)
3↓+3NH
4+ );
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:洗涤;冷却;
(5)最后氧化铁为ag,氧化铁含有铁元素的质量为

×ag=0.7ag,故每片补血剂含铁元素的质量为
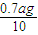
=0.07ag,故答案为:0.07a;
(6)①精确配制一定物质的量浓度的KMnO
4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶,故答案为:250mL容量瓶;
②稀硝酸、浓硝酸具有强氧化性,含有氧化Fe
2+,高锰酸钾可以氧化HCl为氯气,故选硫酸酸化,故选:b;
③高锰酸钾为紫色,当滴定到终点时,Fe
2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色,故答案为:紫.
点评:本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、化学计算等、氧化还原滴定应用,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


 ×ag=0.7ag,故每片补血剂含铁元素的质量为
×ag=0.7ag,故每片补血剂含铁元素的质量为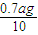 =0.07ag,故答案为:0.07a;
=0.07ag,故答案为:0.07a;

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案