
【题目】“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次…,价值数倍也”。这里用到的分离方法为( )
A. 蒸馏 B. 升华 C. 萃取 D. 蒸发
科目:高中化学 来源: 题型:
【题目】某化学小组利用如图装置进行某些气体的制备和性质实验,图中加持装置有省略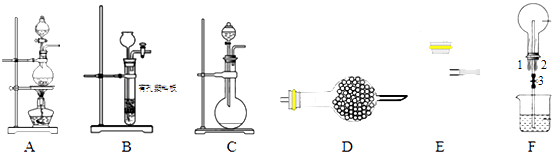
(1)为制取干燥氨气,可将装置C与装置D连接,则装置D中 的固体宜选用a.碱石灰 b.无水氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净干燥的氯气,则两个E装置内的药品依次是
(3)装置F可用于探究氯气和氨气反应,实验室打开开关1、3,关闭2,先向烧瓶中通入 , 然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体.实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子 .
(4)利用装置A、E,可设计实验比较氯离子和溴离子的还原性强弱,能证明结论的实验现象是 . 若利用装置A、E进行乙烯与溴水反应的实验,必须对装置A进行的改动是 .
(5)将装置B、C分别于F相连后,进行硫化氢和二氧化硫反应的实验,烧杯中的试剂所起的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不用其它任何试剂鉴别下列5种物质的溶液:①KOH ②MgSO4 ③Ba(NO3)2 ④CuCl2 ⑤KNO3,被鉴别出来的正确顺序是
A. ⑤④③②① B. ④①②③⑤ C. ②③①④⑤ D. ④①⑤②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠是一种重要的化工原料.工业上用硫酸钠来制得硫化钠.制备硫化钠的反应原理为:Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g)﹣Q,已知该可逆反应在1000℃时达到平衡,并保持反应器内恒温恒容.试回答下列问题:
(1)此可逆反应的平衡常数表达式可表示为 , 若只改变一个影响因素,当平衡移动时,K值变化(填“一定”或“不一定”);当K值变大时,逆反应速率 . (填“增大”、“减小”或“不变”)
(2)该反应达到平衡时下列说法错误的是 . a.容器内压强保持不变
b.氢气和水蒸汽的物质的量之比保持不变
c.加入少量Fe3O4固体,平衡向逆反应方向移动
d.移除部分Na2S固体,平衡向正反应方向移动
(3)该温度下,在2L盛有2.84g Na2SO4的密闭容器中通入H2气体,10分钟后测得固体质量为2.264g.则10分钟内H2的平均反应速率为 .
(4)往Ba(ClO)2溶液中通入足量SO2气体后,溶液中的溶质是 .
(5)向亚硫酸钠中滴加酚酞,溶液变为红色,若在该溶液中再滴入过量的BaCl2溶液,现象是 , 请结合离子方程式,运用平衡原理进行解释: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在A1C13和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如图所示(b处NaOH的体积为l L)
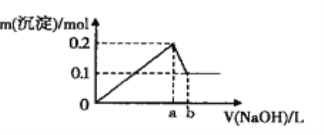
则下列判断正确的是
A. 图中线段oa:ab=3:l B. NaOH溶液物质的量浓度为0.6 mol·L-1
C. 在b点处溶液中的溶质只有NaAlO2 D. 混合溶液中Al3+与Mg2+物质的量比值为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图5个装置都是中学化学中常见的实验装置,某学习小组的同学欲用这些装置进行常见物质的制取并探究其性质(图中a、b、c表示止水夹),请对其进行完善或评价,试回答下列问题:
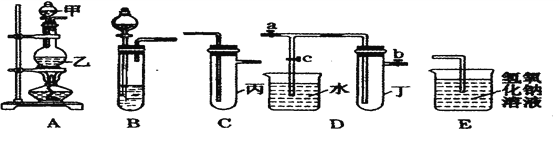
(1)将A、C、E相连后,以浓盐酸和_______(填写名称)为原料制取Cl2,仪器乙的名称是________。写出实验中制备氯气的离子方程式___________________。
(2)利用(1)中装置和药品,在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验实验操作、现象、结论如下:
实验序号 | 实验操作 | 现象 | 结论 |
Ⅰ | 将所得氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
Ⅱ | 向所得氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应至少产生一种酸性强于碳酸的物质 |
实验Ⅰ获得结论是否合理?_________(填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由):___________________________________________。
实验Ⅱ获得结论是否合理?_________(填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由):______________________________________________。
(3)利用(1)中装置还可设计一个简单的实验比较Cl-和S2-的还原性强弱。则C中预期出现的现象是______________________________________________________________。
(4)将B、D、E装置相连接(打开止水夹a和止水夹b,关闭止水夹c),在B中盛装浓硝酸和铜片(将铜片放在有孔塑料板上),可制得NO2。一段时间后,欲用D装置探究NO2与水的反应,其操作步骤为:先______________________________,再____________________________以使烧杯中的水进入试管丁,观察现象。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,Fe2+结合S2﹣的能力大于结合OH﹣的能力,而Al3+则正好相反.在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是( )
A.Al2S3、FeS和S
B.Fe(OH)3和Al(OH)3
C.Fe2S3和Al(OH)3
D.FeS、Al(OH)3和S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度,在1L恒容密闭容器中,加入10molCO、7molH2S,发生如下反应:CO(g)+H2S(g)COS(g)+H2(g),达平衡时CO物质的量为8mol,下列说法正确的是( )
A.该温度下,化学平衡常数K=0.1
B.H2S的平衡转化率为20%
C.增大CO浓度,平衡正向移动,可以提高CO的转化率
D.升高温度,H2S浓度增加,表明该反应正方向是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列有关叙述错误的是
A. 28g 由N2 与CO组成的混合气体中所含的原子数为2NA
B. 78g Na2O2 中所含的阴离子数为NA
C. 0.1molSO2 与0.1molO2充分反应后生成的SO2分子数为0.1 NA
D. 0.1molCu溶于足量稀硝酸中,转移的电子数为0.2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com