
分析 (1)①2H2(g)+O2(g)═2H2O(I)△H1=-572kJ•mol-1
②2HI(g)═H2(g)+I2(g)△H2=+10kJ•mol-1
③2H2SO4(I)═2SO2(g)+2H2O(g)+O2(g)△H3=+462kJ•mol-1
结合盖斯定律计算,(①+2×②+③)×$\frac{1}{2}$得到热化学方程式为:2HI (g)+H2SO4(I)=SO2(g)+I2(g)+2H2O(I)△H=-90KJ/mol,方向改变得所需热化学方程式;
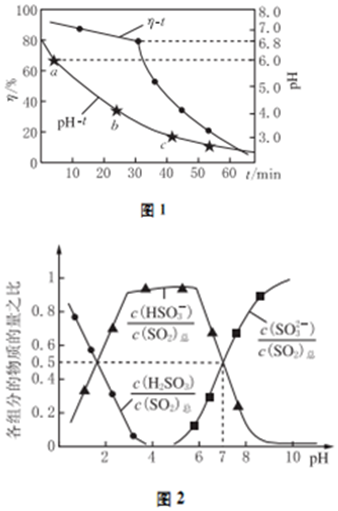
(2)①根据图1中SO2的吸收效率η与时间、溶液的pH的关系对各选项进行判断;
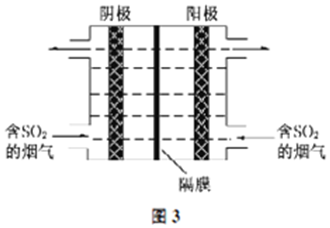
②ab段溶液的pH介于4~6之间,结合图2可知,该pH条件下溶液中主要存在亚硫酸氢根离子,则pH-t曲线ab段发生反应为亚硫酸锌与二氧化硫反应生成亚硫酸氢锌;
③根据图2可知,当溶液的pH=7时,溶液的亚硫酸氢根离子和亚硫酸根离子相同,物质的量之比图形中可知为1:1;
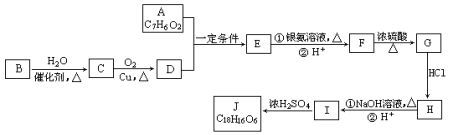
(3)利用惰性电解电解含SO2的烟气回收S及H2SO4,以实现废物利用,阴极上是二氧化硫得到电子生成硫单质,阳极上是二氧化硫失电子被氧化生成硫酸,
①阴极上是二氧化硫得到电子生成硫单质;
②每处理含19.2g SO2的烟气,理论上回收S、H2SO4的物质的量结合阳极和阴极电极反应和电子守恒计算;
解答 解:(1)①2H2(g)+O2(g)═2H2O(I)△H1=-572kJ•mol-1
②2HI(g)═H2(g)+I2(g)△H2=+10kJ•mol-1
③2H2SO4(I)═2SO2(g)+2H2O(g)+O2(g)△H3=+462kJ•mol-1
结合盖斯定律计算,(①+2×②+③)×$\frac{1}{2}$得到热化学方程式为:2HI (g)+H2SO4(I)=SO2(g)+I2(g)+2H2O(I)△H=-45KJ/mol,方向改变得所需热化学方程式:SO2(g)+I2(g)+2H2O(I)═2HI (g)+H2SO4(I)△H=+45KJ/mol,
故答案为:+45;
(2)①增大悬浊液中ZnO的量,可以充分吸收二氧化硫,从而提高吸收效率,根据图1中吸收效率与溶液的Ph关系看,溶液的pH越低,吸收效率越低,为提高SO2的吸收效率η,增大悬浊液中ZnO的量,溶液的pH在6.8以上时吸收效率最增大,
故答案为:调节溶液的pH至6.8以上;
②段溶液的pH介于4~6之间,结合图2可知,该pH条件下溶液中主要存在亚硫酸氢根离子,则pH-t曲线ab段发生的主要反应为:ZnSO3+SO2+H2O=Zn (HSO3)2,
故答案为:ZnSO3+SO2+H2O=Zn(HSO3)2;
③根据图2可知,当溶液的pH=7时,溶液的亚硫酸氢根离子和亚硫酸根离子相同,物质的量之比图形中可知为1:1,ZnSO3,Zn(HSO3)2按照1:0.5混合,锌离子和亚硫酸根离子物质的量之比=$\frac{3}{2}$,
故答案为:$\frac{3}{2}$;
(3)①阴极上是二氧化硫得到电子生成硫单质,电极反应为:SO2+4H++4e-=S↓+2H2O,
故答案为:SO2+4H++4e-=S↓+2H2O;
②每处理含19.2g SO2的烟气物质的量=$\frac{19.2g}{64g/mol}$=0.3mol,阴极上是二氧化硫得到电子生成硫单质,电极反应为:SO2+4H++4e-=S↓+2H2O,阳极电极反应为:SO2-2e-+2H2O=SO42-+4H+,电子守恒得到S~2H2SO4~4e-,
理论上回收S、H2SO4的物质的量分别为0.1mol,0.2mol,
故答案为:0.1mol、0.2mol.
点评 本题考查了热化学方程式书写和盖斯定律的计算应用、图象变化的特征、电解池原理和电极反应书写等知识点,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 实验操作及现象 | 实验结论 | |
| A | 分别向2mL 0.1mol•L-1 CH3COOH溶液和2mL 0.1mol•L-1 H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 | 酸性:CH3COOH>H2CO3>H3BO3 |
| B | 向2mL 0.1mol•L-1 NaOH溶液中滴加3滴0.1mol•L-1 MgCl2溶液,出现白色沉淀后,再滴加3滴0.1mol•L-1 FeCl3溶液,出现红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| C | 过氧化钠用于呼吸面具中作为氧气的来源 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | 向含有淀粉的FeI2溶液中滴加足量的氯水后变蓝 | 还原性:I->Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
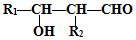
 ,G中含氧官能团的名称羟基、羧基.
,G中含氧官能团的名称羟基、羧基. $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$  +2H2O.
+2H2O.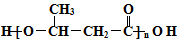 的路线图
的路线图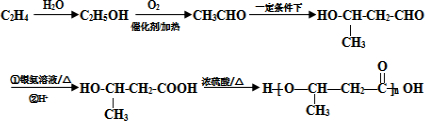 (提示:路线图的书写方法RCH=CH2
(提示:路线图的书写方法RCH=CH2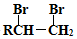 $→_{水/加热}^{NaOH}$
$→_{水/加热}^{NaOH}$ 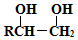 )
)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
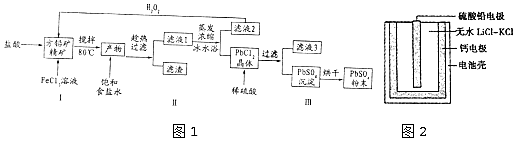
| 物质 | Ksp | 物质 | 开始沉淀时pH | 完全沉淀时pH |
| PbSO4 | 1.0×10-8 | Fe(OH)3 | 2.7 | 3.7 |
| PbCl2 | 1.6×10-5 | Fe(OH)2 | 6 | 7.04 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,2-二甲苯也称邻二甲苯 | |
| B. | 氨基乙酸与a-氨基丙酸的混合物一定条件下脱水能生成4种二肽 | |
| C. | 苯与溴水不能发生加成反应,所以两者混合后无明显现象 | |
| D. | C5H10O2属于羧酸的同分异构体有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含有FeCl2的溶液中通入适量氯气,当有1molFe2+被氧化时,该反应转移电子数目为3NA | |
| B. | 40gCuO和Cu2S混合物中所含铜原子的数目不等于0.5NA | |
| C. | 含0.1molNH4HSO4的溶液中,阳离子数目略小于0.2NA | |
| D. | C3H8分子中的2个H原子分别被1个-NH2和1个-OH取代,1mol此有机物所含共用电子对数目为13NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L Cl2中含有的分子数为6.02×1023个 | |
| B. | 0.1mol/LNa2CO3溶液加热后,溶液的pH减小 | |
| C. | 氢氧燃料电池工作时,H2在负极上失去电子 | |
| D. | 室温下,稀释0.1mol/LCH3COOH溶液,溶液的导电能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
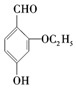 )是食品添加剂的增香原料.
)是食品添加剂的增香原料.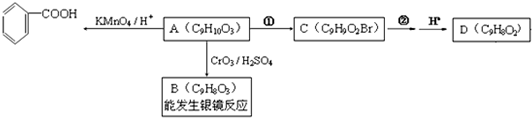
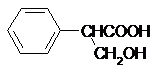 ,B
,B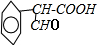 .
.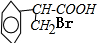 +H2O$→_{△}^{NaOH}$
+H2O$→_{△}^{NaOH}$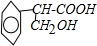 +HBr.
+HBr.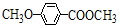 )是一种医药中间体.由茴香醛(
)是一种医药中间体.由茴香醛(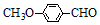 )合成E(其他原料自选),涉及的反应类型有(按反应顺序填写)氧化、酯化.
)合成E(其他原料自选),涉及的反应类型有(按反应顺序填写)氧化、酯化.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com