
| A. | 原电池是将电能转变为化学能的装置 | |
| B. | 原电池阳极发生氧化反应 | |
| C. | 电解池阴极发生还原反应 | |
| D. | 电解池的阴极连接电源正极 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
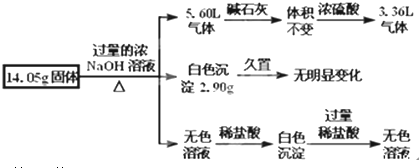
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
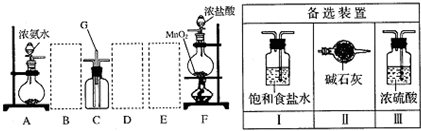
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ③④⑤ | C. | ④⑥⑦ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用镀锡铁做罐头盒,当镀层破坏后锡能对铁提供保护 | |
| B. | 用铜作电极电解稀硫酸,发生反应:Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑ | |
| C. | 某原电池的电极材料分别为Mg和Al,则Mg一定做负极 | |
| D. | 某可逆反应升高温度,活化能大的方向化学反应速率增大程度小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
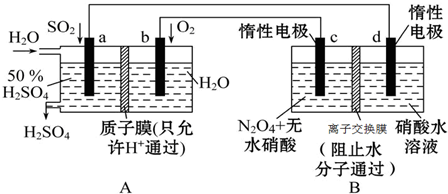
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净水:Al3++3H2O∧Al(OH)3+3H+ | |
| B. | 氯气通入水中:Cl2+H2O?2H++ClO-+Cl- | |
| C. | 铜和硝酸银溶液反应:Cu+2Ag+═Cu2++2Ag | |
| D. | 稀硫酸与氢氧化钡溶液反应:Ba2++OH-+H++SO42-═H2O+BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com