
【题目】已知:![]() (主要产物)1 mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下所示的一系列变化。
(主要产物)1 mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下所示的一系列变化。
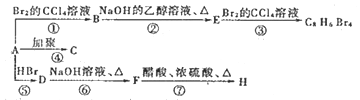
(1)A的化学名称___________,B的分子式为___________。
(2)上述反应中,②是_______反应 (填反应类型) 。
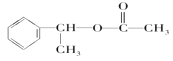
(3)写出E、H物质的结构简式E______,H ________。
(4)出D-F反应的化学方程式 ____________。
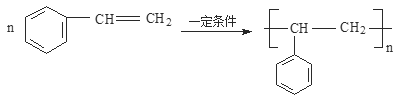
(5)写出A—C反应的化学方程式 __________。
(6)满足下列条件的H的同分异构体有________种。(除H外)
①苯环上只有一个支链。②与H宫能团相同且能够水解。
【答案】 苯乙烯 C8H8Br2 消去 ![]()
![]()
 13
13
【解析】1mol某烃A充分燃烧后可以得到8molCO2和4molH2O,故烃A的分子式为C8H8,不饱和度为(2×8+28)÷2=5,可能含有苯环,由A发生加聚反应生成C,故A中含有不饱和键,A为![]() ,C为
,C为 ,A与溴发生加成反应生成B,B为
,A与溴发生加成反应生成B,B为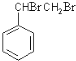 ,B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,E为
,B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,E为![]() ,E与溴发生加成反应生成
,E与溴发生加成反应生成![]() ,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上,A与HBr放出加成反应生成D,D为
,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上,A与HBr放出加成反应生成D,D为![]() ,
,![]() 在氢氧化钠水溶液、加热条件下发生水解反应生成F,F为
在氢氧化钠水溶液、加热条件下发生水解反应生成F,F为![]() ,
,![]() 与乙酸发生酯化反应生成H,H为
与乙酸发生酯化反应生成H,H为![]() ,则
,则
(1)由上述分析可知,A的结构简式为![]() ,名称是苯乙烯;B的结构简式为
,名称是苯乙烯;B的结构简式为 ,化学式为 C8H8Br2;(2)上述反应中,②是卤代烃的消去反应;(3)根据以上分析可知E、H物质的结构简式分别为
,化学式为 C8H8Br2;(2)上述反应中,②是卤代烃的消去反应;(3)根据以上分析可知E、H物质的结构简式分别为![]() 、
、![]() ;(4)D→F是D在氢氧化钠水溶液、加热条件下发生水解反应生成F,反应方程式为:
;(4)D→F是D在氢氧化钠水溶液、加热条件下发生水解反应生成F,反应方程式为:![]() ;(5)A—C反应的化学方程式为
;(5)A—C反应的化学方程式为 ;(6)①苯环上只有一个支链。②与H官能团相同且能够水解,即含有酯基,该酯基的结构简式为-OOCCH2CH2CH3、-OOCCH(CH3)2、-CH2OOCCH2CH3、-CH2CH2OOCCH3、-CH(CH3)OOCCH3、-CH/span>2CH2CH2OOCH、―CH(CH3)CH2OOCH、―C(CH3)2OOCH、―CH2CH(CH3)OOCH、-COOCH2CH2CH3、-COOCH(CH3)2、-CH2COOCH2CH3、-CH2CH2COOCH3、-CH(CH3)COOCH3,合计13种(除H外)。
;(6)①苯环上只有一个支链。②与H官能团相同且能够水解,即含有酯基,该酯基的结构简式为-OOCCH2CH2CH3、-OOCCH(CH3)2、-CH2OOCCH2CH3、-CH2CH2OOCCH3、-CH(CH3)OOCCH3、-CH/span>2CH2CH2OOCH、―CH(CH3)CH2OOCH、―C(CH3)2OOCH、―CH2CH(CH3)OOCH、-COOCH2CH2CH3、-COOCH(CH3)2、-CH2COOCH2CH3、-CH2CH2COOCH3、-CH(CH3)COOCH3,合计13种(除H外)。


科目:高中化学 来源: 题型:
【题目】已知苯可以进行如下转化:
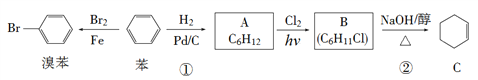
回答下列问题:
(1)反应①的反应类型为________,化合物A的化学名称为___________。
(2)化合物B的结构简式为_________,反应②的反应类型为_______。
(3)如何仅用水鉴别苯和溴苯__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从化学键的观点看,化学反应的实质是“旧键的断裂,新键的形成”,据此你认为下列变化属于化学反应的是( )
A. 对空气进行降温加压 B. 金刚石变成石墨
C. NaCl熔化 D. 碘溶于CCl4中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )
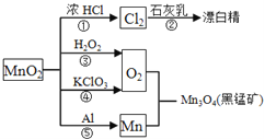
A. 反应①②③④⑤均属于氧化反应和离子反应
B. 反应⑤说明该条件下铝的还原性强于锰
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1︰1
D. 反应①中氧化剂与还原剂的物质的量之比为1︰4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下物质:①NaHSO4晶体,②液态O2 ,③冰醋酸(固态醋酸), ④汞,⑤BaSO4固体,⑥Fe(OH)3 胶体,⑦酒精(C2H5OH) ,⑧熔化KNO3,⑨盐酸,⑩金属钠,请回答下列问题(用序号):
(1)以上物质中能导电的是__________
(2)以上物质属于电解质的是_____________
(3)以上物质中属于非电解质的是_______
(4)请写出①在熔融状态下的电离方程式________________
(5)a. 写出制备⑥的实验操作为_________;
b. 制备⑥的离子方程式为____________________,
c. 在制得的⑥中逐滴加入稀硫酸的实验现象为_____________________________。
(6)写出⑩在加热条件下与氧气反应的化学方程式________________________。若将2.3克钠放入97.7克水中,生成的溶液中溶质的质量分数_________(填“大于”、“小于” 或“等于”)2.3%。
(7)标准状况下,CO与CO2相对于②的密度为1,则混合气体中CO与CO2的比例为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. 所有主族中都有非金属元素 B. 同周期元素中,VIA族元素的原子半径最大
C. 过渡元素都是金属元素 D. VIA族元素的原子,其半径越大,越容易得到电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下: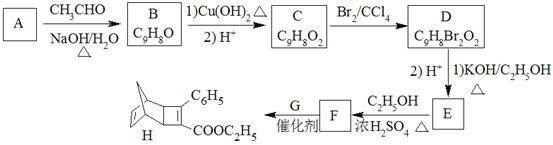
已知:
![]()
![]()
回答下列问题:
(1)A的化学名称为为__________。
(2)由C生成D和E生成F的反应类型分别为__________、_________。
(3)E的结构简式为____________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶2∶1,写出2种符合要求的X的结构简式____________。
(6)写出用环戊烷和2-丁炔为原料制备化合物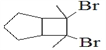 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由氮的化合物引起的环境污染称为氮污染。
(1)己知CO将NO转化为N2的方程式为2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH,某研究小组在实验中研究温度对NO转化率的影响并绘制图像。
N2(g)+2CO2(g) ΔH,某研究小组在实验中研究温度对NO转化率的影响并绘制图像。
①当n(NO)/n(CO)=l,容器容积恒定时,在不同温度下反应相同的时间测得NO的转化率变化如图所示,则在此反应时间内应控制反应的最佳温度在______左右,该反应的ΔH_____0 (填>或<)。

②该反应的平衡常数表达式为K=__________。
要同时提高平衡常数的值和NO的平衡转化率,可采取的措施是________。
A.降低温度 B.及时将CO2和N2从反应体系中移走
C.升高温度 D.增大压强
③在恒温恒容容器中按体积比2∶1充入CO和NO的混合气体,下列选项能说明正反应速率大于逆反应速率的是_____________(填序号)。
A.CO的浓度保持恒定 B.混合气体的平均相对分子质量逐渐减小
C.CO和NO的物质的量之比逐渐增大 D.CO、NO、N2的速率之比为2∶2∶1
(2)在催化剂存在的条件下,用H2可以将NO还原为N2,己知:

则氢气和一氧化氮反应生成氮气和水蒸气的热化学方程式是_________________。
(3)MAP沉淀法是一种比较新颖有效的处理氨氮废水的方法,.原理如下:向含NH4+的废水中投加磷酸盐和镁盐,使之和NH4+生成难溶复盐MgNH4PO4·6H2O (简称MAP)。MAP沉淀法需要控制反应的PH在7.5-10之间,当PH过高时不利于生成MAP的原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块铁片放入0.5L 1mol/L CuSO4溶液中,反应一段时间后,取出铁片,小心洗净后干燥称量,铁片增重0.8g,则反应后溶液中CuSO4的物质的量浓度是(反应前后溶液的体积不变)
A. 0.9 mol/L B. 0.85 mol/L C. 0.8 mol/L D. 0.75 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com