
【题目】最近科学家利用下列装置图成功地实现了CO2和H2O合成CH4。下列叙述错误的是( )
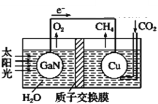
A. 电池工作时,实现了将太阳能转化为电能
B. 铜电极为正极,电极反应式为CO2+4e-+8H+=CH4+2H2O
C. 电池内 H+ 透过质子交换膜从左向右移动
D. 为提高该人工光合系统的工作效率,可向装置中加入少量稀硫酸
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学教师为“氯气与金属钠反应”设计了如图装置的实验。实验操作:先给钠预热,等钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述中错误的是
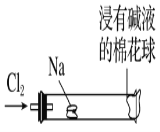
A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气
C.钠着火产生黄色火焰,自然界中存在游离态钠
D.若在棉花球外沿滴一滴石蕊溶液,据其颜色变化判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是

A.反应的化学方程式为2X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.10s后,该反应停止进行
C.反应开始到10s,用Z表示的反应速率为0.158mol·L-1·s-1
D.0~10 s的时间内的平均反应速率:v(X)=v(Y)=0.0395mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金只含铝、铁、铜三种元素,取合金![]() ,加入到含
,加入到含![]() 稀硝酸的溶液中,恰好完全反应,放出无色气体11.2L(标准状况下)。将反应后的溶液分成2等份,向一份溶液中滴加
稀硝酸的溶液中,恰好完全反应,放出无色气体11.2L(标准状况下)。将反应后的溶液分成2等份,向一份溶液中滴加![]() ,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体cg,减轻了5.4g,再加入到过量的
,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体cg,减轻了5.4g,再加入到过量的![]() 溶液中,剩余不溶物dg。下列说法不正确的是
溶液中,剩余不溶物dg。下列说法不正确的是
已知;![]() 遇到
遇到![]() 会出现蓝色沉淀。
会出现蓝色沉淀。
A. ![]()
B. 原合金中铜的质量为![]()
C. 若将上述![]() 稀硝酸逐滴加入到合金中,放出气体仍为
稀硝酸逐滴加入到合金中,放出气体仍为![]() (标准状况下)
(标准状况下)
D. d不是一确定值,可能为8
查看答案和解析>>
科目:高中化学 来源: 题型:
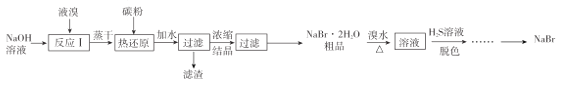
【题目】无水![]() 的制备流程如下:
的制备流程如下:
已知:①![]() ;
;
②![]() 溶于
溶于![]() 溶液生成
溶液生成![]() ,离子方程式可表示为
,离子方程式可表示为![]() 。
。
请回答:
(1) “反应I”所用![]() 溶液最好是饱和溶液,理由是____________
溶液最好是饱和溶液,理由是____________
(2)已知“热还原”反应中,氧化剂和还原剂物质的量之比为![]() ,若该反应中消耗了
,若该反应中消耗了![]() 碳粉,则理论上最终可制得
碳粉,则理论上最终可制得![]() 的质量为_____________(不考虑制备过程中的损失)。
的质量为_____________(不考虑制备过程中的损失)。
(3)“脱色”过程中生成了两种强酸,写出该过程的离子方程式:______________________
(4)用![]() 与
与![]() 溶液反应是制备
溶液反应是制备![]() 的另一种方法,反应过程中有气体和沉淀生成,写出此方法的化学方程式:___________________
的另一种方法,反应过程中有气体和沉淀生成,写出此方法的化学方程式:___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下浓度均为0.1 mol·L-1的下列各溶液的pH如下表所示,下列有关说法正确的是( )
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B. 若将CO2通入0.1 mol·L-1 Na2CO3溶液中至溶液呈中性,则溶液中2c(CO32-)+c(HCO3-)=0.1 mol·L-1(忽略溶液体积变化)
C. 根据上表,水解方程式ClO-+H2O![]() HClO+OH-的平衡常数K≈10-7.6
HClO+OH-的平衡常数K≈10-7.6
D. 向上述NaClO溶液中通过量CO2气体的离子方程式为:2ClO-+CO2+H2O === 2HClO+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19gcm-3HCl的质量分数:36.5%
(1)该浓盐酸中HCl的物质的量浓度为__________mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是______。
a.溶液的浓度
b.溶液中HCl的质量
c.溶液中Cl-的数目
d.溶质的质量分数
(3)某学生欲用上述浓盐酸和蒸馏水配制40mL物质的量浓度为0.400mol/L的稀盐酸。
①该学生需要量取_______ mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?______(填“偏大”、“偏小”、“无影响”)
a.用量筒量取浓盐酸时仰视观察凹液面
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
(4)①假设该同学成功配制了0.400mol/L的盐酸,他又用该盐酸中和含0.8gNaOH的溶液,则该同学需取_______ mL盐酸。
②假设该同学用新配制的盐酸中和含0.8g NaOH的溶液,发现比①中所求体积偏小则可能的原因是_______。
a.加水时超过刻度线,用胶头滴管吸出
b.配制溶液时,未洗涤烧杯
c.配制溶液时,俯视容量瓶刻度线
d.配置溶液时,量取浓盐酸后用蒸馏水洗涤量筒并转移至烧杯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列检验方法和结论正确的是 ( )
A. 加入硝酸银溶液有白色沉淀生成,证明原溶液中一定有Cl-
B. 在加入稀硝酸后的溶液中,再滴加氯化钡溶液有白色沉淀生成,证明原溶液中一定有SO![]()
C. 加入盐酸后加热,放出能使澄清石灰水变浑浊的无色无味气体,证明原溶液中一定含有CO![]()
D. 加入紫色石蕊试液,溶液显红色,证明溶液一定呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验图示不能完成实验描述的是
选项 | 实验描述 | 实验图示 |
A | 该实验能验证氧化性: H2O2>Br2>H2SO3 |
|
B | 该实验能够实现比较HCl、H2CO3、H2SiO3酸性的强弱 |
|
C | 该实验装置用于干燥、收集并吸收多余氨气 |
|
D | 该实验能验证SO2的氧化性、还原性 |
|
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com