
 (用电子式表示).
(用电子式表示).分析 (1)①给出的离子中,只有Fe3+遇KSCN溶液显红色,Fe3+与KI发生氧化还原反应生成的碘单质,易溶于有机溶剂,且碘在四氯化碳中显紫色;
②具有氧化性的离子为IO3-、Fe3+,具有还原性的离子为I-,利用氧化还原反应来分析;
(2)根据KI具有还原性及氧化还原反应、KI3在常温下不稳定性来分析;
(3)根据提高加碘盐(添加KI)的稳定性,主要是防止I- 被氧化来分析.
解答 解:(1)某加碘盐可能含有KIO3、KI、Mg2+、Fe3+,用蒸馏水溶解,并加稀盐酸酸化后将溶液分为3份.从第一份试液中滴加KSCN溶液后显红色,可知该加碘盐中含有Fe3+,反应:Fe3++3SCN-=Fe(SCN)3,Fe(SCN)3呈血红色;从第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色,可知有碘生成.这是因为由于“氧化性:IO3->Fe3+>I2”,加足量KI后,IO3-和Fe3+均能将I-氧化成I2,由此也可以知道该加碘盐添加KIO3;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.由此可知该加碘盐中不含KI.
①该加碘盐溶液中加KSCN溶液显红色的物质是Fe(SCN)3,CCl4中显紫红色的物质是I2,电子式 ,
,
故答案为:Fe(SCN)3; ;
;
②第二份试液中加入足量KI固体后,反应的离子方程式为IO3-+5I-+6H+═3I2+3H2O、2Fe3++2I-═2Fe2++I2,
故答案为:IO3-+5I-+6H+═3I2+3H2O;2Fe3++2I-═2Fe2++I2;
(2)KI作为加碘剂的食盐在保存过程中,KI会被空气中氧气氧化,KI在潮湿空气中氧化的反应化学方程式为:4KI+O2+2H2O═2I2+4KOH,根据题目告知,KI3•H2O是在低温条件下,由I2溶于KI溶液可制得.再由题给的信息:“KI+I2?KI3”,可知KI3在常温下不稳定性,受热(或潮湿)条件下易分解为KI和I2,KI又易被空气中的氧气氧化,I2易升华,所以KI3•H2O作为食盐加碘剂是不合适的,
故答案为:4KI+O2+2H2O═2I2+4KOH;否;KI3受热(或潮湿)条件下产生KI和I2,KI被氧气氧化,I2易升华;
(3)提高加碘盐(添加KI)的稳定性,主要是防止I- 被氧化,根据题给信息“还原性:S2O32->I-”和氧化还原反应的强弱规律,可以选Na2S2O3作稳定剂;又由题给信息
“3I2+6OH-═IO3-+5I-+3H2O”,可知I2与OH-会发生反应生成IO3-和5I-,而Na2CO3水解呈碱性,因而也可以用Na2CO3作稳定剂,防止加碘盐(添加KI)在潮湿环境下被氧气氧化.至于AlCl3,水解后呈酸性,且还原性I->Cl-,所不能作稳定剂;NaNO2当遇强还原性物质时能表现出氧化性,则NaNO2与KI能发生氧化还原反应为2NO2-+2I-+4H+=2NO↑+I2+2H2O,所以不能作稳定剂,
故答案为:AC.
点评 本题以日常生活中熟悉的食盐和加碘盐中碘的损失原因为素材,要求通过实验,检验加碘盐中所含有的成分物质,探究保存过程中由于空气中氧气的作用容易引起碘损失的反应、探讨KI3•H2O作为食盐加碘剂是否合适、以及提高加碘盐(添加KI)的稳定性可添加的稳定剂,设计实验方案检验选用KI作为加碘剂的加碘盐中的Fe2+等,综合考查解决实际问题的能力,题目难度中等.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关.与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象.臭氧浓度升高是光化学烟雾形成的标志.请回答下列相关问题:
近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关.与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象.臭氧浓度升高是光化学烟雾形成的标志.请回答下列相关问题:| 实验序号 | c(NH4+)/mol•L-1 | c(NO2-)/mol•L-1 | ν/mol•L-1•s-1 |
| 1 | 0.0100 | 0.200 | 5.4×10-7 |
| 2 | 0.0200 | 0.200 | 1.08×10-6 |
| 3 | 0.200 | 0.040 | 2.16×10-6 |
| 4 | 0.200 | 0.060 | 3.24×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

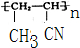
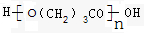
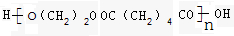 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X不可能是金属元素 | |
| B. | 元素X的气态氢化物易溶于水 | |
| C. | 元素X能形成化学式为KXO3的盐 | |
| D. | 工业上制取X的单质时一定采用氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液中c(OH-):①=② | |
| B. | 两溶液的物质的量浓度:①=② | |
| C. | 两溶液分别加水稀释10倍,稀释后溶液的pH:①>② | |
| D. | 等体积的两溶液分别与同浓度的盐酸完全中和,消耗盐酸的体积:①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LCl2溶于足量水中转移电子的数目为0.1NA | |
| B. | 标准状况下,22.4L苯中含有双键的数目为3NA | |
| C. | 常温下,16gO2和O3的混合气体中含有氧原子的数目为NA | |
| D. | 25℃时,pH=1的醋酸溶液中含有H+的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 处理废弃物 | B. | 治理污染点 | C. | 减少有毒物排放 | D. | 杜绝污染源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一次剩余4.8 g金属为铜和铁 | |
| B. | 稀硝酸的物质的量浓度为1.0 mol•L-1 | |
| C. | 原混合物中铜和铁各0.075 mol | |
| D. | 再加入上述100 mL稀硝酸,又得到标准状况下1.12 L NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com