
已知下列几个反应的化学方程式:
① 2H2S + SO2 = 3S↓+ 2H2O
② 2KI + Cl2 = 2KCl + I2
③ 2FeCl2 + Cl2 = 2FeCl3
④ 2FeCl3 + 2HI =2FeCl2 + I2 + 2HCl
⑤ I2 + SO2 + 2H2O = H2SO4+ 2HI
下列有关物质的氧化性的强弱排列顺序中正确的是
A. Cl2 >Fe3+ >I2 >SO2 B. Cl2 >I2 >Fe3+>SO2
C. Cl2 >Fe3+ >SO2 >I2 D. Fe3+ >I2 >Cl2 >SO2
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:阅读理解
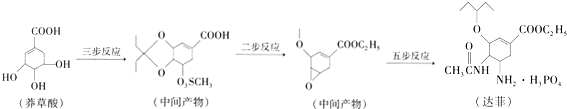




查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| △ |
| ||
| 加入药品 | 不加MnSO4的硫酸 酸化的H2C2O4溶液 |
加少量MnSO4的硫酸 酸化的H2C2O4溶液 |
| 实验现象 (褪色时间)/s |
H2C2O4褪色很慢 (31秒) |
H2C2O4褪色很快(4秒) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
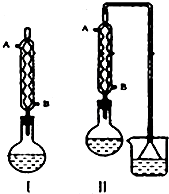 由正丁醇(用n-C4H9OH表示)制备正溴丁烷(沸点:101.6℃)的反应如下:
由正丁醇(用n-C4H9OH表示)制备正溴丁烷(沸点:101.6℃)的反应如下:| 浓H2SO4 |
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源:江苏省盐城中学2008-2009学年度高二上学期期中考试(化学)(选修) 题型:022
氢叠氮酸HN3是一种弱酸,它和CH3COOH相似为一元弱酸,N3-被称为类卤离子,试回答下列问题:
(1)HN3呈弱酸性的电离方程式为:_____________
(2)若HN3分子中每个原子均达到了8电子或2电子稳定结构,写出HN3的电子式:_____________
(3)实际情况并不是(2)中所述,HN3的分子成键情况如下图所示,

则HN3分子中有________个σ键,其中与H相连的N原子的杂化类型为________
(4)![]() 与常见分子________互为等电子体,则推断
与常见分子________互为等电子体,则推断![]() 的空间构型是________.
的空间构型是________.
(5)以金属Cu、石墨作电极,以盐酸、HN3混合溶液作电解质溶液组成原电池,正极有气泡产生;一段时间后电流减弱,在负极周围滴入几滴浓盐酸后又使电流增大,已知原电池总反应为:2HCl+2Cu=2CuCl+H2↑,CuCl微溶于水,易溶于浓盐酸.
写出正极反应式_____________,负极反应式_____________,根据已学的分子结构知识推断CuCl溶于浓盐酸的可能原因是生成了_________物.
查看答案和解析>>
科目:高中化学 来源:台湾省高考真题 题型:单选题


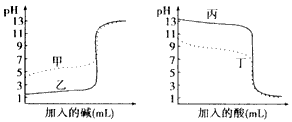

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com