
| A. | 汽车尾气的排放是造成温室效应的主要原因 | |
| B. | 碘是人体必需的微量元素,但食用过量也会引起甲亢 | |
| C. | 纤维素在人体内可水解成葡萄糖,供人体组织的营养需要 | |
| D. | 明矾是常用的水处理剂,可用于城市自来水的杀菌消毒 |
分析 A.汽车尾气的排放主要含氮的氧化物;
B.碘为人体必需的微量元素,过多、过少都影响人的成长;
C.人体内没有纤维素酶;
D.明矾水解生成胶体,具有吸附性,不具有强氧化性.
解答 解:A.汽车尾气的排放主要含氮的氧化物,而二氧化碳为造成温室效应的主要原因,故A错误;
B.碘为人体必需的微量元素,过多、过少都影响人的成长,则食用过量也会引起甲亢,故B正确;
C.人体内没有纤维素酶,则纤维素在人体内不能水解成葡萄糖,故C错误;
D.明矾水解生成胶体,具有吸附性,不具有强氧化性,则不能杀菌消毒,故D错误;
故选B.
点评 本题考查物质的性质、用途,为高频考点,把握物质的性质、发生的反应及化学与生活等为解答该题的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液中Na+、K+、[Fe(CN)6]3-、I- 可以大量共存 | |
| B. | 滴加稀硫酸,充分振荡无现象 | |
| C. | 通入H2S气体,发生反应的离子方程式为Fe2++S2-═FeS↓ | |
| D. | 50 mL该溶液与过量Zn充分反应,生成0.56 g Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
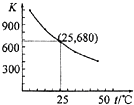 已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大. I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq).测得不同温度下该反应的平衡常数如图所示,下列说法正确的是( )
已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大. I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq).测得不同温度下该反应的平衡常数如图所示,下列说法正确的是( )| A. | 反应I2(aq)+I-(aq)?I3-(aq)的△H>0 | |
| B. | 利用该反应可以除去硫粉中少量的碘单质 | |
| C. | 在上述平衡体系中加入苯,平衡不移动 | |
| D. | 25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 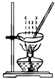 所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| B. | 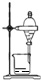 所示装置,分离CCl4萃取I2水后的有机层 | |
| C. | 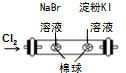 所示装置,证明氧化性:Cl2>Br2>I2 | |
| D. | 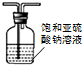 所示装置,除去SO2中混有的少量HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
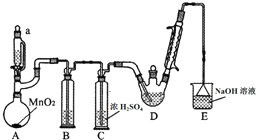 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -1 14.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作及现象 | 结论 | |
| A | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| B | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有白色固体析出 | 蛋白质均发生变性 |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色. | Br-还原性强于Cl- |
| D | 将0.1mol•L-1MgSO4溶液滴入NaOH溶液至不再有白色沉淀产生,再滴加0.1mol•L-1FeCl3溶液,白色沉淀变为红褐色沉淀 | 在水中的溶解度 Mg(OH)2<Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中植物通过光合作用将太阳能转化为生物质能,而农村沼气池的建造、农作物制乙醇,都是有效的利用生物质能 | |
| B. | 纳米TiO2光触媒技术制成的“木地板精油”能将水气转化为活性氧,可以有效降解甲醛、苯、氨等居室污染物 | |
| C. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强酸、强碱都会“断路” | |
| D. | 同位素在医学显像、诊断和治疗,以及在改进农产品质量、增加产量等技术方面应用广泛 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com