

 3Cu + N2↑+ 3H2O
3Cu + N2↑+ 3H2O 3Cu + N2↑+ 3H2O。
3Cu + N2↑+ 3H2O。

 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
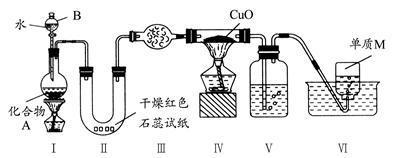
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
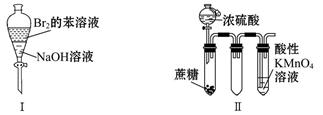
| A.振荡后静置,上层溶液颜色保持不变 |
| B.实验Ⅱ:酸性KMnO4溶液中出现气泡,颜色无变化 |
| C.实验Ⅲ:微热稀硝酸片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D.实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
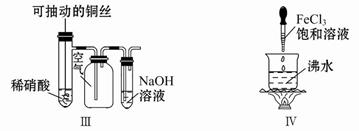
 | 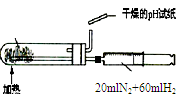 | 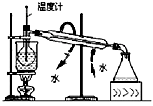 | 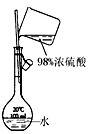 |
| A.测定乙醇分子结构 | B.合成氨并检验氨的生成并回收CCl4 | C.碘的CCl4溶液中分离I2 | D.配制稀硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验内容 | 实验目的 |
| A | 将SO2通入品红溶液中,品红褪色;加热褪色后品红溶液,溶液恢复红色 | 证明亚硫酸的不稳定性 |
| B | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生 | 证明常温下KSP(BaSO4)>KSP(BaCO3) |
| C | 常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
| D | 将浓硫酸和碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中CO2的存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
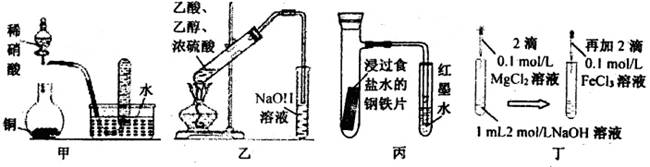
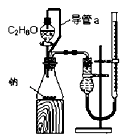
| A.甲图:验证铜与稀硝酸反应的气体产物只有NO |
| B.乙图:实验室制取乙酸乙酯 |
| C.丙图:验证钢铁片发生吸氧腐蚀 |
| D.丁图:证明在相同温度下Mg(OH)2的溶解度大于Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
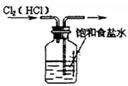 |  | 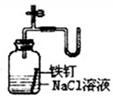 | 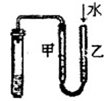 |
| ①除去Cl2中的HCl杂质 | ②用铜和稀硝酸制取少量NO | ③证明铁生锈时空气参与反应 | ④检验装置气密性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com