
下列说法正确的是( )
A.实验室中的浓硝酸呈现黄色,是因为浓硝酸具有强氧化性
B.澄清石灰水可用来鉴别Na2CO3和NaHCO3溶液
C.NO和NO2密度比空气大,所以均可用向上排空气法收集
D.在海轮外壳上镶入锌块可减缓船体的腐蚀,是利用了原电池的原理
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.目前加碘食盐中主要添加的是KIO3
B.日常生活中无水乙醇常用于杀菌消毒
C.绿色食品是不含任何化学物质的食品
D.在空气质量日报中CO2含量属于空气污染指数
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针 偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Zn | 浓硝酸 | 偏向Al |
根据上表中的实验现象完成下列问题:
(1)实验1、2中Al所作的电极是否相同? 。
(2)指出实验3中铝和石墨的电极名称,并写出实验中的电极反应和电池总反应。
铝为( ) ; 石墨为( ) 。
电池总反应: 。
(3)实验4中的铝作正极还是负极? ,为什么? 。
查看答案和解析>>
科目:高中化学 来源: 题型:
类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
|
| 已知 | 类推 |
| A | 将Fe加入CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
| B | 向稀硫酸加入NaOH溶液至中性 H++OH-=H2O | 向H2SO4溶液加入Ba(OH)2溶液至中性 H++OH-=H2O |
| C | 向氯化铝溶液中加入足量NaOH溶液 Al3+ + 4OH- = AlO2- + 2H2O | 向氯化铝溶液中加入足量氨水 Al3+ + 4NH3·H2O = AlO2- + 2H2O +4NH4+ |
| D | 向Ca(OH)2溶液中通入过量CO2 CO2 + OH- = HCO3- | 向Ca(OH)2溶液中通入过量SO2 SO2 + OH- = HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
两个化学兴趣小组进行了以下探究活动:
第一组:为研究铁质材料与热浓硫酸的反应,
(1)称取铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中是否含有Fe2+,应选择加入的试剂为 (选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取672 mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g。据此推知气体Y 中SO2的体积分数为 。
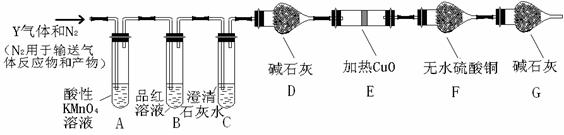 分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(2)写出产生CO2的化学方程式 。
(3)装置A中试剂的作用是 ,反应的离子方程式 。
(4)简述确认气体Y中含有CO2的实验现象 。
(5)如果气体Y中含有H2,预计实验现象应是 。
 第二组:拟用下列装置定量分析空气中SO2的含量:
第二组:拟用下列装置定量分析空气中SO2的含量:
(6)KMnO4溶液中导管末端做成球状多孔结构的作用是
(7)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L。若从气体通入到紫色恰好褪去,用时5分钟。则此次取样处的空气中二氧化硫含量为 g/L
查看答案和解析>>
科目:高中化学 来源: 题型:
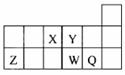
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是( )
A.元素X与元素Z的最高正化合价之和的数值等于8
B.离子Y2-和Z 3+的核外电子数和电子层数均相同
C.元素W的最高价氧化物对应的水化物的酸性比Q的弱
D.元素X气态氢化物的稳定性大于元素Y的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
取少量MgO、Al2O3、SiO2、Fe2O3的混合粉末,加入过量盐酸,充分反应后过滤,得到固体X和滤液Y。下列叙述正确的是( )
A.上述四种氧化物中,至少有三种是碱性氧化物
B.将固体X加入氢氟酸中,X会溶解
C.滤液Y中的阳离子只有Mg2+、Al3+、Fe3+三种
D.滤液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
有一化合物X,可发生如下的转化关系(部分反应物、生成物省略)。其中B、D、E、F均为无色气体,W、K为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和W反应可放出大量的热。
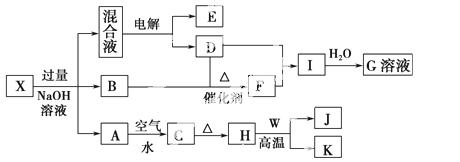
(1)X中滴入过量NaOH溶液的离子方程式为__________________________。
(2)I和水反应生成G的化学方程式为________________________________。
(3)I转化为G的反应中,当有2 mol G生成时,转移的电子数为_______________________________________________________________。
(4)引发H和W反应的操作是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X为第三周期元素的原子,该原子要达到8电子稳定结构,则需要的电子数小 于其次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是( )
A.X元素最高价氧化物对应的水化物一定是强酸
B.X元素的氢化物的化学式一定为H2X
C.X的单质一定是良好的半导体材料
D.X元素的氧化物一定能与烧碱反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com