
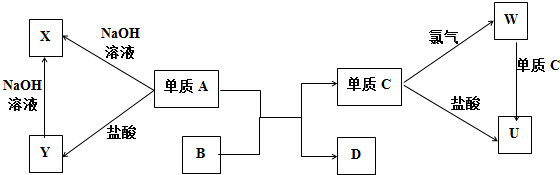
·ÖĪö A”¢CŹĒÉś»īÖŠ³£ÓƵÄĮ½ÖÖ½šŹō£¬ĘäÓąĪļÖŹ¾łĪŖ»ÆŗĻĪļ£¬ĒŅ»ÆŗĻĪļBŹĒŗģ×ŲÉ«·ŪÄ©£¬ŌņBĪŖFe2O3£¬µ„ÖŹAÓėB·“Ӧɜ³Éµ„ÖŹCÓėD£¬øĆ·“Ó¦Ó¦ĪŖĀĮČČ·“Ó¦£¬AĪŖAl£¬CĪŖFe£¬DĪŖAl2O3£¬ĢśÓėĀČĘų·“Ӧɜ³ÉWĪŖFeCl3£¬ĢśÓėŃĪĖį·“Ӧɜ³ÉUĪŖFeCl2£¬ĀĮÓėĒāŃõ»ÆÄĘ·“Ӧɜ³ÉXĪŖNaAlO2£¬ĀĮÓėŃĪĖį·“Ӧɜ³ÉYĪŖAlCl3£¬ĀČ»ÆĀĮÓė¹żĮæµÄĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĘ«ĀĮĖįÄĘ£¬ĀČ»ÆĢśÓėĢś·“Ӧɜ³ÉĀČ»ÆŃĒĢś£¬·ūŗĻø÷ĪļÖŹµÄ×Ŗ»Æ¹ŲĻµ£¬¾Ż“Ė“šĢā£®
½ā“š ½ā£ŗA”¢CŹĒÉś»īÖŠ³£ÓƵÄĮ½ÖÖ½šŹō£¬ĘäÓąĪļÖŹ¾łĪŖ»ÆŗĻĪļ£¬ĒŅ»ÆŗĻĪļBŹĒŗģ×ŲÉ«·ŪÄ©£¬ŌņBĪŖFe2O3£¬µ„ÖŹAÓėB·“Ӧɜ³Éµ„ÖŹCÓėD£¬øĆ·“Ó¦Ó¦ĪŖĀĮČČ·“Ó¦£¬AĪŖAl£¬CĪŖFe£¬DĪŖAl2O3£¬ĢśÓėĀČĘų·“Ӧɜ³ÉWĪŖFeCl3£¬ĢśÓėŃĪĖį·“Ӧɜ³ÉUĪŖFeCl2£¬ĀĮÓėĒāŃõ»ÆÄĘ·“Ӧɜ³ÉXĪŖNaAlO2£¬ĀĮÓėŃĪĖį·“Ӧɜ³ÉYĪŖAlCl3£¬ĀČ»ÆĀĮÓė¹żĮæµÄĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĘ«ĀĮĖįÄĘ£¬ĀČ»ÆĢśÓėĢś·“Ӧɜ³ÉĀČ»ÆŃĒĢś£¬·ūŗĻø÷ĪļÖŹµÄ×Ŗ»Æ¹ŲĻµ£¬
£Ø1£©AĪŖAl£¬ĀĮŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒµŚČżÖÜĘŚµŚ¢óA×壬¹Ź“š°øĪŖ£ŗµŚČżÖÜĘŚµŚ¢óA×壻
£Ø2£©ĀČ»ÆĀĮÓė¹żĮæµÄĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĘ«ĀĮĖįÄĘ£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ Al3++4OH-=AlO2-+2H2O£¬ĀČ»ÆĢśÓėĢś·“Ӧɜ³ÉĀČ»ÆŃĒĢś£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ 2Fe3++Fe=3Fe2+£¬
¹Ź“š°øĪŖ£ŗAl3++4OH-=AlO2-+2H2O£» 2Fe3++Fe=3Fe2+£»
£Ø3£©ĀČ»ÆŃĒĢśµÄČÜŅŗÖŠ¼ÓČėNaOHČÜŅŗÉś³É°×É«µÄĒāŃõ»ÆŃĒĢś£¬ŌŚæÕĘųÖŠ·ÅÖĆŅ»¶ĪŹ±¼ä£¬¹Ū²ģµ½µÄĻÖĻóŹĒÓŠ°×É«³Įµķ³öĻÖ£¬°×É«³ĮµķŃøĖŁ±äĪŖ»ŅĀĢÉ«£¬Öš½„±äĪŖŗģŗÖÉ«£¬
¹Ź“š°øĪŖ£ŗÓŠ°×É«³Įµķ³öĻÖ£¬°×É«³ĮµķŃøĖŁ±äĪŖ»ŅĀĢÉ«£¬Öš½„±äĪŖŗģŗÖÉ«£»
£Ø4£©a£®¹¤ŅµÖŠæÉÓƵē½āČŪČŚŃõ»ÆĀĮµÄ·½·ØŅ±Į¶µ„ÖŹĀĮ£¬¹ŹaÕżČ·£»
b£®øł¾Żµē×ӵƏ§ŹŲŗćæÉÖŖ£¬ĻąĶ¬ĪļÖŹµÄĮæµÄĀĮÓė¹żĮæŃĪĖį”¢NaOHČÜŅŗ·“Ӧɜ³ÉµÄĒāĘųµÄÖŹĮæĻąµČ£¬¹ŹbÕżČ·£»
c£®WĪŖFeCl3£¬æÉŅŌÓĆKSCNČÜŅŗ¼ģŃéĢśĄė×Ó£¬¹ŹcÕżČ·£¬
¹ŹŃ”abc£®
µćĘĄ ±¾Ģāæ¼²éĪŽ»śĪļĶʶĻ£¬ĪļÖŹµÄŃÕÉ«”¢ÓĆĶ¾¼°ĀĮČČ·“Ó¦ĪŖĶʶĻĶ»ĘĘæŚ£¬ŠčŅŖѧɜŹģĮ·ÕĘĪÕŌŖĖŲ»ÆŗĻĪļÖŖŹ¶£¬ÄѶČÖŠµČ£®


 ½š×“ŌŖ¼ØÓÅŗĆ¾ķĻµĮŠ“š°ø
½š×“ŌŖ¼ØÓÅŗĆ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £»
£»²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
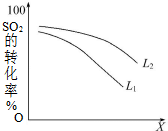 Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚ2LĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗ2SO2£Øg£©+O2£Øg£©?2SO3£Øg£©”÷H=-196kJ•mol-1
Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚ2LĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗ2SO2£Øg£©+O2£Øg£©?2SO3£Øg£©”÷H=-196kJ•mol-1²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.3 mol/L Na2SO4ČÜŅŗÖŠŗ¬ÓŠNa+ŗĶSO42-×ÜĪļÖŹµÄĮæĪŖ0.9mol | |
| B£® | µ±1LĖ®ĪüŹÕ22.4LNH3Ź±ĖłµĆ°±Ė®µÄÅØ¶Č²»ŹĒ1 mol/L£¬Ö»ÓŠµ±22.4L NH3ČÜÓŚĖ®ÖʵĆ1L°±Ė®Ź±£¬ĘäÅØ¶Č²ÅŹĒ1 mol/L | |
| C£® | 10”ꏱ0.5 mol/LµÄĻ”ŃĪĖį100mL£¬Õō·¢µō5gĖ®£¬ĄäČ“µ½10”ꏱ£¬ĘäĢå»żŠ”ÓŚ100mL£¬ĖüµÄĪļÖŹµÄĮæÅØ¶Č“óÓŚ0.5 mol/L | |
| D£® | 10”ꏱ0.5 mol/LµÄKCl±„ŗĶČÜŅŗ100mL£¬Õō·¢µō5gĖ®£¬ĄäČ“µ½10”ꏱ£¬ĘäĢå»żŠ”ÓŚ100 mL£¬ĖüµÄĪļÖŹµÄĮæÅضČČŌĪŖ0.5 mol/L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | £Ø5£©£Ø2£©£Ø1£©£Ø3£©£Ø4£© | B£® | £Ø5£©£Ø2£©£Ø3£©£Ø1£©£Ø4£© | C£® | £Ø4£©£Ø2£©£Ø1£©£Ø3£©£Ø5£© | D£® | £Ø4£©£Ø2£©£Ø1£©£Ø5£©£Ø3£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | n£ØCl2£©£ŗn£ØFe£©=5£ŗ4 5Cl2+4Fe $\frac{\underline{\;µćČ¼\;}}{\;}$2FeCl2+2FeCl3 | |
| B£® | n£ØCl2£©£ŗn£ØFeBr2£©=1£ŗ1 Fe2++2Br-+Cl2ØTFe3++Br2+2Cl- | |
| C£® | n£ØMnO4-£©£ŗn£ØH2O2£©=2£ŗ3 2MnO4-+3H2O2+6H+ØT2Mn2++4O2”ü+6H2O | |
| D£® | n£ØFe£©£ŗn[HNO3£ØĻ”£©]=1£ŗ3 4Fe+12H++3NO3-ØT3Fe2++Fe3++3NO”ü+6H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĀČ»ÆĀĮČÜŅŗÖŠ¼ÓČė¹żĮæ°±Ė®£ŗAl3++4NH3•H2OØT[Al£ØOH£©4]-+4NH4+ | |
| B£® | ³ĪĒåŹÆ»ŅĖ®Óė¹żĮæĖÕ“ņČÜŅŗ·“Ó¦£ŗCa2++HCO3-+OH-ØTCaCO3”ż+H2O | |
| C£® | Ģ¼ĖįøĘČÜÓŚ“×Ėį£ŗCaCO3+2H+ØTCa2++CO2”ü+H2O | |
| D£® | µā»ÆŃĒĢśÖŠĶØČėĀČĘų£ŗ2I-+Cl2ØTI2+2Cl- |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com