
| A. | 在pH=1溶液中:NH4+、Fe2+、NO3-、Cl- | |
| B. | 由水电离的c(H+)=10-12 mol•L-1的溶液:AlO2-、K+、CO32-、Na+ | |
| C. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、CO32- | |
| D. | 所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+ |
分析 A.pH=1的溶液中存在大量氢离子,硝酸根离子在酸性条件下能够氧化亚铁离子;
B.由水电离的c(H+)=10-12 mol•L-1的溶液中存在大量氢离子或氢氧根离子,碳酸根离子、偏铝酸根离子与氢离子反应;
C.使酚酞试液变红的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
D.碳酸根离子与铝离子发生双水解反应.
解答 解:A.pH=1的溶液呈酸性,Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.由水电离的c(H+)=10-12 mol•L-1的溶液呈酸性或碱性,AlO2-、CO32-与氢离子反应,在酸性溶液中不能大量共存,故B错误;
C.使酚酞试液变红的溶液呈碱性,溶液中存在大量氢氧根离子,Na+、Cl-、SO42-、CO32-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.CO32-、Al3+之间发生反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
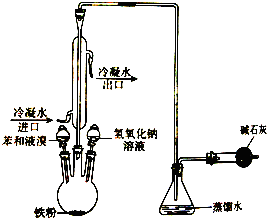 如图是实验室制取溴苯的装置图,请回答下列问题:
如图是实验室制取溴苯的装置图,请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,B 同周期第一电离能最小的主族元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B 同周期第一电离能最小的主族元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: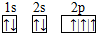 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 ,该化合物属于离子化合物(填“共价”或“离子”).
,该化合物属于离子化合物(填“共价”或“离子”). ,该化合物含的化学键类型是共价键.
,该化合物含的化学键类型是共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲肾上腺素的分子式为:C8H10NO3 | |
| B. | 1 mol去甲肾上腺素最多能与2 mol Na发生反应 | |
| C. | 1 mol去甲肾上腺素最多能与2 mol Br2发生取代反应 | |
| D. | 去甲肾上腺素能发生加成、取代、消去和氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
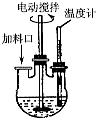 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 裂化可以提高汽油等轻质油的产量和质量 | |
| B. | 硬脂酸甘油酯皂化反应后得到的主要产品是硬脂酸和甘油 | |
| C. | 乙醇、乙酸、乙酸乙酯分子中均存在-OH | |
| D. | 向2mL苯中加入1mL碘的CCl4溶液,振荡后静置,上层呈紫色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com