
【题目】已知含氧酸可用通式XOm(OH)n表示,如X是S,m=2,n=2,则这个式子表示为H2SO4 . 一般而言,该式子中m大的是强酸,m小的是弱酸.下列各含氧酸中酸性最强的是( )
A.HClO3
B.H2SeO3
C.H3PO4
D.HMnO4
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.
(1)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.已知:H2(g)+Cl2(g)=2HCl(g)△H=﹣a kJmol﹣1;E(H﹣H)=b kJmol﹣1 , E(Cl﹣Cl)=c kJmol﹣1 , 则:E(H﹣Cl)=;
(2)氯原子对O3的分解有催化作用:O3(g)+Cl(g)=ClO(g)+O2(g)△H1 , ClO(g)+O(g)=Cl(g)+O2(g)△H2 , 大气臭氧层的分解反应是O3+O=2O2△H.该反应的能量变化示意图如图1所示.则反应O3(g)+O(g)=2O2(g)的正反应的活化能为kJmol﹣1 . 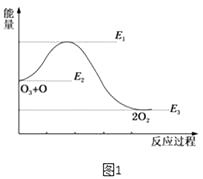
(3)实验中不能直接测出由石墨和氢气反应生成甲烷反应的反应热,但可测出CH4、石墨和H2燃烧反应的反应热,求由石墨生成甲烷的反应热.已知:
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣a kJmol﹣1
②C(石墨)+O2(g)═CO2(g)△H=﹣b kJmol﹣1
③H2(g)+ ![]() O2(g)═H2O(l)△H=﹣c kJmol﹣1
O2(g)═H2O(l)△H=﹣c kJmol﹣1
则反应C(石墨)+2H2(g)→CH4(g)的反应热:
△H=kJmol﹣1 .
又已知:该反应为放热反应,△H﹣T△S可作为反应方向的判据,当△H﹣T△S<0时可自发进行;则该反应在什么条件下可自发进行 . (填“低温”、“高温”)
(4)有图2所示的装置,该装置中Cu极为极;当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为L. 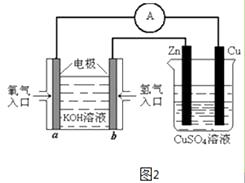
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组的同学欲探究测定草酸晶体(H2C2O4xH2O)中x的值.通过查阅资料该小组同学得知:草酸易溶于水,其水溶液可以与酸性KMnO4溶液发生反应2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.该组同学利用该反应原理设计了滴定的方法测定x值.
①称取1.260g纯草酸晶体,将其制成100.00mL水溶液为待测液.
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,实验记录有关数据如下:
滴定次数 | 待测草酸溶液体积(mL) | 0.1000mol/LKMnO4标准溶液体积(mL) | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 10.02 |
第二次 | 25.00 | 0.22 | 11.32 |
第三次 | 25.00 | 1.56 | 11.54 |
请回答: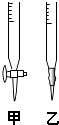
(1)滴定时,将KMnO4标准液装在右图中的(填“甲”或“乙”)滴定管中.
(2)本实验滴定达到终点的标志可以是 .
(3)通过上述数据,计算出x= .
(4)①若滴定终点时俯视滴定管刻度,则由此测得的x值会(填“偏大”、“偏小”或“不变”,下同).
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池(总反应:2PbSO4+2H2O ![]() Pb+PbO2+4H++2SO42﹣ )电解苦卤水 (含C1﹣、Br﹣、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
Pb+PbO2+4H++2SO42﹣ )电解苦卤水 (含C1﹣、Br﹣、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( ) 
A.铅蓄电池放电时的正极反应是:PbO2+4H++SO42﹣═PbSO4+2H2O
B.电解苦卤水时,a 电极首先放电的是Br﹣而不是Cl﹣ , 说明当其它条件相同时Br﹣的还原性强于Cl﹣
C.铅蓄电池充电时,A极应与外接电源负极相连
D.忽略能量消耗,当b极产生0.02g气体时,铅蓄电池中消耗0.01 molH2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向2L体积固定的密闭容器中加入1molHI,2HIH2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确的是( ) 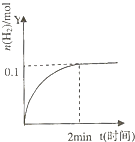
A.该温度下,反应的平衡常数是 ![]()
B.0~2min内的HI的平均反应速率为0.05mol?L﹣1?min﹣1
C.恒压下向该体系中加入N2 , 平衡不移动,反应速率不变
D.升高温度,平衡向正反应方向移动,只有正反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素单质从F2到I2在常温常压下的聚集状态由气态、液态到固态的原因是( )
A.原子间的化学键键能逐渐减小
B.范德华力逐渐增大
C.原子半径逐渐增大
D.氧化性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品安全国家标准(GB2760﹣2014)规定葡萄酒中SO2最大使用量为0.25g/L.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2 , 并对SO2性质进行探究. 
(1)(i)仪器A的名称是;
(ii)仪器B中加入300mL葡萄酒和适量盐酸,加热使SO2全部逸出,并与C中H2O2完全反应,C中化学反应方程式为;
(2)小组同学为探究SO2的漂白性和还原性,设计了如下实验.
a漂白性 用如图2所示装置(气密性良好)进行实验,观察到如下现象:ⅰ中红色褪去、ⅱ中无变化.
(i)足量碱石灰的作用是;
(ii)从实验中可知使品红的水溶液褪色的微粒可能是;
b还原性 将SO2通入FeCl3溶液中,使其充分反应.
(iii)SO2与FeCl3反应的离子方程式是 , 如何检验该反应所得含氧酸根离子
(iv)实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色.
已知:红棕色为FeSO3(墨绿色难溶物)与FeCl3溶液形成的混合色;Fe3+可氧化SO32﹣;则②中红棕色变为浅绿色的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一化学反应中,反应物A的浓度在3s内从1.0 mol/L变为0.4 mol/L ,在这3s内A的化学反应速率为
A. 1.8 mol/(L·s)B. 1.2 mol/(L·s)C. 0.6mol(L·s)D. 0.2 mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com