
【题目】下列有关说法不正确的是
A.催化剂既能改变化学反应速率又能改变化学反应限度
B.升高温度能改变工业合成氨的反应速率
C.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
D.把锌粒放入盛有稀盐酸的试管中,加入几滴氯化铜溶液,能加快生成![]() 的速率
的速率
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰。海水冻结时,部分来不及流走的盐分以卤汁的形式被包围在冰晶之间,形成“盐泡”![]() 假设盐分以一个NaCl计
假设盐分以一个NaCl计![]() ,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )
,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )

A.海冰内层“盐泡”越多,密度越小
B.海冰冰龄越长,内层的“盐泡”越多
C.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
D.海冰内层NaCl的浓度约为![]() 设冰的密度为
设冰的密度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在常温下,下列四种溶液:①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③0.1mol/L NH4HSO4④0.1mol/L NH3H2O,请根据要求填写下列空白:
(1)溶液①呈____ 性(填“酸”、“碱”或“中”),其原因是______(用离子方程式表示)。
(2)在上述四种溶液中,pH最小的是________。
(3)比较四种溶液中c(NH4+)的由大到小的顺序是______________(填序号)。
(4)四种溶液中,离子浓度为0.1 mol/L的是___________(填离子符号)。
Ⅱ. KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中的某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作如下所述:称取稍多于所需要的KMnO4固体溶于水中,将溶液加热并保持微沸1h;用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;过滤得到的KMnO4溶液贮存于棕色试剂瓶中并放在暗处;利用氧化还原反应滴定法,在70~80℃条件下用基准试剂溶液标定其浓度.
请回答下列问题:
(1)准确量取一定体积的KMnO4溶液需要使用的仪器是_____________。
(2)若选择H2C2O4 2H2O(M=126g/mol)作为基准试剂,准确称取Wg溶于水配成500mL溶液,配制溶液时,所用仪器除烧杯、胶头滴管和玻璃棒外,还需要_______。取25.00mL置于锥形瓶中,用KMnO4溶液滴定至终点,消耗KMnO4溶液VmL,则KMnO4溶液的物质的量浓度为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关立方烷分子式:C8H8,结构简式![]() ,下列说法不正确的是
,下列说法不正确的是
A.它的一氯代物只有一种同分异构体,其二氯代物有两种同分异构体
B.分子中存在极性键、非极性键,是一种非极性分子
C.它不是芳香烃,但与苯乙烯互为同分异构体
D.它含碳质量分数与乙炔、苯等物质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述错误的是
A.分子中N—Cl键键长与CCl4分子中C—Cl键键长不相等
B.NCl3分子是极性分子
C.NBr3比NCl3易挥发
D.在氨水中,大部分NH3与H2O以氢键(用“![]() ”表示)结合形成NH3H2O分子,则NH3H2O的结构式为
”表示)结合形成NH3H2O分子,则NH3H2O的结构式为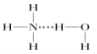
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热△H为
Si(s)+4HCl(g),该反应的反应热△H为
A. +236 kJ·mol-1B. -236 kJ·mol-1
C. +412 kJ·mol-1D. -412 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有M、N、P、Q四块金属片,进行如下实验:
① M、N用导线相连后,同时插入硫酸铜溶液中,N极变粗
②P、Q用导线相连后,同时浸入稀![]() 中,Q是电子流入的一极
中,Q是电子流入的一极
③M、P相连后,同时浸入稀![]() ,P极产生大量气泡
,P极产生大量气泡
④N、Q相连后,同时浸入稀![]() 中,Q极发生氧化反应
中,Q极发生氧化反应
则四种金属的活动性顺序为
A.M>N>P>QB.M>P>Q>NC.N>Q>P>MD.P>M>N>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C(g)ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
2C(g)ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
(1)a________b(填“>”“=”或“<”)。
(2)该反应的平衡常数表达式为________,若将反应温度升高到700 ℃,该反应的平衡常数将________(填“增大”“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是________。
a.v(C)=2v(B2) b.容器内压强保持不变 c.v逆(A2)=2v正(B2) d.容器内的密度保持不变
(4)使该反应的反应速率增大,且平衡向正反应方向移动的操作是________。
a.及时分离出C气体 b.适当升高温度 c.增大B2的浓度 d.选择高效的催化剂
(5)密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为________。
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是_____________________________________。(请用离子方程式加文字进行描述)
(2)相同条件下,0.1molL﹣1NH4Al(SO4)2中c(NH4+)________________(填“等于”、“大于”或“小于”)0.1molL﹣1 NH4HCO3中c(NH4+)。
(3)如图1是0.1molL﹣1电解质溶液的pH随温度变化的图象
①其中符合0.1molL﹣1NH4Al(SO4)2的pH随温度变化的曲线是__________(填写序号)。
②25℃时,0.1molL﹣1NH4Al(SO4)2中2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)=__________________ molL﹣1(写出精确结果)。
(4)室温时,向100mL 0.1molL﹣1 NH4HSO4溶液中滴加0.1molL﹣1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图2中a、b、c、d四个点,水的电离程度最大是__________点;在b点,溶液中各离子浓度由大到小的排列顺序是______________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com