
| A. | pH=0的溶液:Fe2+、Mg2+、NO3-、SO42- | |
| B. | 由水电离出的c(H+)=1×10-13mol/L的溶液:Al3+、K+、SO42-、Cl- | |
| C. | $\frac{c({OH}^{-})}{c({H}^{+})}$=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | pH=14的溶液:Na+、K+、Al3+、CO32- |
分析 A.pH=0的溶液,显酸性,离子之间发生氧化还原反应;
B.由水电离出的c(H+)=1×10-13mol/L的溶液,为酸或碱溶液;
C.$\frac{c({OH}^{-})}{c({H}^{+})}$=1012的溶液,显碱性;
D.pH=14的溶液,显碱性.
解答 解:A.pH=0的溶液,显酸性,Fe2+、H+、NO3-发生氧化还原反应,不能大量共存,故A错误;
B.由水电离出的c(H+)=1×10-13mol/L的溶液,为酸或碱溶液,酸溶液中该组离子之间不反应,可大量共存,故B正确;
C.$\frac{c({OH}^{-})}{c({H}^{+})}$=1012的溶液,显碱性,碱性溶液中不能大量存在NH4+、Al3+,且Al3+、CO32-相互促进水解不能共存,故C错误;
D.pH=14的溶液,显碱性,碱性溶液中不能大量存在Al3+,且Al3+、CO32-相互促进水解不能共存,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应、水解反应的离子共存考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
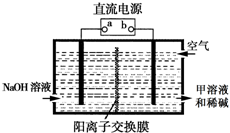 X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X元素一种原子核无中子.Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素.
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X元素一种原子核无中子.Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A、C两点的正反应速率的关系为A>C | |
| B. | A、B、C、D、E各状态中,v(正)<v(逆)的是状态E | |
| C. | 维持P1不变,E→A所需时间为x;维持P2不变,D→C所需时间为y,则x<y | |
| D. | 使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是从P1突然加压至P2,再由P2无限缓慢降压至P1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、H+、Cl-、HCO3- | B. | Na+、Fe2+、Cl-、OH- | ||
| C. | NH4+、CO32-、NO3-、Ba2+ | D. | Cu2+、Fe3+、Mg2+、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com