
| 实验序号 | 0.1032mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00 |
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
分析 (1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),恰好完全反应得到MCl溶液,测得混合溶液的pH=6,说明得到的盐是强酸弱碱盐,混合溶液中由水电离出的c(H+)10-6mol/L,而0.2mol/LHCl溶液中由水电离出的c(H+)=c(OH-)=$\frac{10{\;}^{-14}}{0.2}$mol/L=5×10-14mol/L;
(2)二者混合得到等物质的量浓度的MCl和MOH,混合溶液呈酸性,说明碱的电离程度小于盐的水解程度;
(3)常温下若将0.1mol/L的HR溶液与0.1mol/L的NaOH溶液等体积混合,两种溶液中c(H+)=c(OH-),如HR为强酸,则反应后呈中性,如为弱酸,则反应后呈酸性;
(4)①先根据数据的有效性,然后求出平均消耗V(NaOH),利用H+、OH-的物质的量相等来计算;
②根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(5)滴定实验是利用沉淀变色指示反应沉淀完全,在氯化银刚好沉淀完成,再滴加硝酸银溶液,与指示剂作用生成不同现象来进行判断;测定水体中氯化物的含量,必须使氯离子完全生成白色沉淀,指示沉淀反应完全的试剂溶解性一定小于氯化银,所以本题应在Ag+和Cl-生成AgCl沉淀后,再生成不同颜色沉淀指示沉淀终点.则指示剂的溶解度应比AgCl大来分析判断.
解答 解:(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),恰好完全反应得到MCl溶液,测得混合溶液的pH=6,说明得到的盐是强酸弱碱盐,混合溶液中由水电离出的c(H+)10-6mol/L,而0.2mol/LHCl溶液中由水电离出的c(H+)=c(OH-)=$\frac{10{\;}^{-14}}{0.2}$mol/L=5×10-14mol/L,故混合溶液中水电离出的c(H+)较大,
故答案为:>;
(2)二者混合得到等物质的量浓度的MCl和MOH,混合溶液呈酸性,说明碱的电离程度小于盐的水解程度,溶液的pH<7;
故答案为:<;
(3)常温下若将0.1mol/L的HR溶液与0.1mol/L的NaOH溶液等体积混合,两种溶液中c(H+)=c(OH-),如HR为强酸,则反应后呈中性,pH=7,如HR为弱酸,NaR水解溶液呈碱性,则混合溶液的pH>7,测得混合溶液的pH≠7,则混合溶液的pH>7;
故答案为:>7;
(4)①三次滴定消耗的体积为:27.83mL,26.53mL,27.85mL,数据26.53mL误差较大,此数据无效,则平均消耗V(NaOH)=$\frac{27.83+27.85}{2}$ml=27.84mL,由酸碱中和的实质可知,27.84mL×0.1032mol/L=25.00mL×c(碱),解得c(碱)=$\frac{27.84mL×0.1032mol/L}{25.00mL}$=0.1149mol•L-1;
故答案为:0.1149;
②A.酸式滴定管未用标准盐酸溶液润洗,溶液被内壁水膜稀释,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故A正确;
B.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故B正确;
C.锥形瓶未用待测液润洗是正确操作,测定结果正确,故C错误;
D.酸式滴定管滴定前平视读数,滴定后俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故D错误;
故选AB.
(5)只有当滴定剂和被滴定物的生成物的溶解度比滴定剂和指示剂的生成物的溶解度小时,完全反应后,继续滴加滴定剂,滴定剂和指示剂反应生成沉淀,保证滴定剂和被滴定物完全反应.
氯化银、溴化银、碘化银的组成都是1:1型,依据Ksp可知溶解性:氯化银>溴化银>碘化银,氯离子未沉淀完全时,碘离子、溴离子即开始沉淀,不符合,
由Ksp=[Ag+]2[S2-]=2.0×10-48,可知S2-开始沉淀时浓度=$\frac{2×1{0}^{-48}}{c{\;}^{2}(A{g}^{+})}$,Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10,可知Cl-开始沉淀时浓度$\frac{1.8×1{0}^{-10}}{c(A{g}^{+})}$,银离子浓度相同时,故硫离子开始沉淀时浓度远远小于氯离子浓度,及硫离子沉淀时,氯离子未完全沉淀,不符合,
由Ksp(Ag2CrO4)=[Ag+]2[CrO42-]=1.8×10-10,可知CrO42-开始沉淀时浓度=$\frac{1.8×1{0}^{-10}}{{c}^{2}(A{g}^{+})}$,大于氯离子浓度,CrO42-开始沉淀时氯离子已经沉淀完全,符合,
故选:D.
点评 本题考查了酸、碱混合的定性判断及有关pH的计算、中和滴定、沉淀滴定、溶解平衡的计算等知识,题目难度较大,属于拼合型题目,是对学生综合能力的考查,


科目:高中化学 来源: 题型:选择题
| A. | “蜡炬成灰泪始干”既包含物理变化又包含化学变化 | |
| B. | Al2O3熔点高,可用于制作耐高温仪器 | |
| C. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| D. | 可用热的饱和Na2CO3溶液除去金属表面的矿物油(主要成分是脂肪烃) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用金属钠可鉴别乙醇和乙醚 | |
| B. | 用新制的银氨溶液可鉴别甲酸乙酯和丙醛 | |
| C. | 用水可鉴别苯和溴苯 | |
| D. | 用酸性高锰酸钾溶液可鉴别己烷和3-己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图是A分子的球棍模型和B分子的比例模型,回答下列问
如图是A分子的球棍模型和B分子的比例模型,回答下列问查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (苯胺,易被氧化);
(苯胺,易被氧化); ,最多有13个原子共面.
,最多有13个原子共面. 的名称为邻羟基苯甲酸,G中官能团名称为羧基、硝基.
的名称为邻羟基苯甲酸,G中官能团名称为羧基、硝基. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
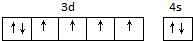 .
. ,该吸附方式能加快反应速率的原因是氮氮三键变成了双键,结构发生改变.
,该吸附方式能加快反应速率的原因是氮氮三键变成了双键,结构发生改变.| X射线衍射 | N-H键长 | N-N距离 | H-N-H键角 |
| 数据 | 101.9pm | 339.0pm | 107° |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com