
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Fe2+、Cl-、NO3-、K+ | |
| B. | 滴入酚酞显红色的溶液中:Na+、Al3+、CO32-、AlO2- | |
| C. | 加入铝粉产生H2的溶液中:Fe2+、Na+、SO42-、ClO- | |
| D. | 0.1mol•L-1 NaHCO3溶液中:Na+、NH4+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
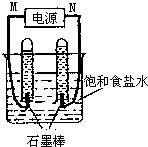 利用反应CO(g)+H2(g)+O2(g)?H2O(g)+CO2(g)设计而成的MCFS燃料电池是一种新型电池.现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置及现象如图所示.则①M应是电源的负极(填“正”或“负”);②该电解反应的化学方程式是2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;③已知饱和食盐水的体积为1L,一段时间后,测得左侧试管中气体体积为11.2mL(标准状况),若电解前后溶液的体积变化忽略不计,电解后将溶液混合均匀,此时溶液的pH为11.
利用反应CO(g)+H2(g)+O2(g)?H2O(g)+CO2(g)设计而成的MCFS燃料电池是一种新型电池.现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置及现象如图所示.则①M应是电源的负极(填“正”或“负”);②该电解反应的化学方程式是2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;③已知饱和食盐水的体积为1L,一段时间后,测得左侧试管中气体体积为11.2mL(标准状况),若电解前后溶液的体积变化忽略不计,电解后将溶液混合均匀,此时溶液的pH为11.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 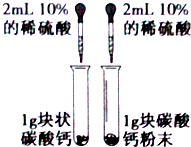 用图装置探究反应物接触面积对反应速率影响 | |
| B. | 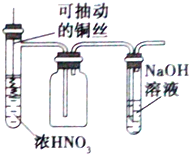 用图装置制取并收集少量的NO2气体(不考虑倒吸) | |
| C. |  用图装置制取并收集少量的氯气 | |
| D. |  用图装置制取少量乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

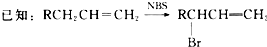
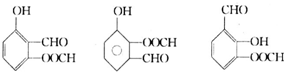 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,1L pH=1的硫酸溶液中含有H+的数为0.2NA | |
| B. | 标准状况下,11.2L NO与11.2L O2混合所含分子数为0.75NA | |
| C. | 在1L的碳酸钠溶液中,若c(CO3 2-)=1mol/L,则Na+个数为2NA | |
| D. | 电镀铜,阳极减少32g,则电路中转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
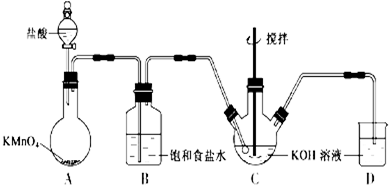
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 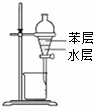 用图所示装置分离苯和水 | |
| B. | 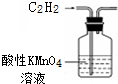 用图所示装置除去C2H2中含有的少量H2S | |
| C. | 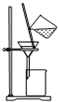 用图所示装置分离NaCl和CaCl2的混合溶液 | |
| D. | 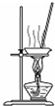 用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com