
����Ŀ����̼���̿�(��Ҫ�ɷ�MnCO3��������FeCO3��MnO2��Al2O3��SiO2��)����ȡ�����̵�һ���������£�
(1) ������������У������Ԫ�ؽ����ʵĴ�ʩ�У��ʵ�������Ũ�ȡ�________________(��һ��)��
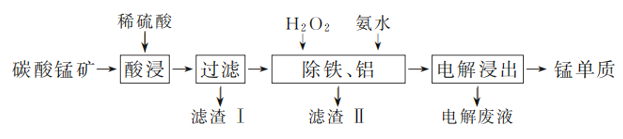
(2) ���������������䣬�ڲ�ͬ�¶��¶�̼���̿�����������Ԫ�صĽ�������ʱ��仯����ͼ��ʾ�������������¶Ⱥ�ʱ��ֱ���________��
 ����
����
��ȡ��������ؽ������������������������pH
�������� | Fe3�� | Fe2�� | Al3�� | Mn2�� |
��ʼ������pH | 1.8 | 5.8 | 3.0 | 7.8 |
��ȫ������pH | 3.2 | 8.8 | 5.0 | 9.8 |
(3) ��֪�����������Һ����Ԫ��ֻ��Mn2����ʽ���ڣ�����������з���������ԭ��Ӧ�����ӷ���ʽΪ________________________________________��
(4) ����ϱ���������������ʱ���백ˮ���Ʒ�ӦҺpH�ķ�ΧΪ________��
(5) �����������м����H2O2����������������Һ�л�����Ԫ�ز��࣬������Ӱ�������̵Ĵ��ȡ�����Ƽ�Ҫʵ�鷽��������֤�������Һ���Ƿ�����Ԫ�أ� _________________��
(6) ��ʯīΪ�缫���������������Һ��õ����̡�����Һ�п�ѭ�����õ�������________��
���𰸡�����̼���̿��ʵ����¡������(��������) 70 ����120 min 2FeCO3��MnO2��8H��===2Fe3����Mn2����2CO2����4H2O 5.0��pH<7.8(��5.0��7.8) ȡ���������еμ�H2O2���ٵ���KSCN��Һ������Һ���Ѫ��ɫ��������Һ�к�����Ԫ�� H2SO4
��������
�̿������Ҫ�ɷ���MnCO3��MnO2��FeCO3��SiO2��Al2O3�ȣ��������ܽ⣬SiO2�������ᷴӦ��MnCO3��FeCO3��Al2O3�����ᷴӦ�õ�MnSO4��FeSO4��Al2(SO4)3������Һ����Ԫ��ֻ��Mn2+����ʽ���ڣ�����������Ҳ��MnO2�����˳�ȥ��������Ȳ����������ΪSiO2�Ȳ��������Һ�м���������⽫Fe2+��������ΪFe3+���ӣ��ټ��백ˮ������ҺpHʹFe3+��Al3+ת��ΪFe(OH)3��Al(OH)3���������˷��룬��Һ�к���MnSO4��NH4SO4�ȣ�������ΪFe(OH)3��Al(OH)3������Һ���õ�Mn���Դ˽����⡣
(1)Ϊ��ߺ��̿���������ʣ��ɲ�ȡ�Ĵ�ʩ����Ӧ��Ũ�ȡ������¶ȡ�����Ӧ��Ӵ�����ȷ������罫��ʯ���顢���¡��ʵ��������Ũ�ȡ����裻
(2)������Խ��Խ�ã�����ʱ��Խ��Խ�ã�����ͼ֪���¶�Խ�߽�����Խ�ߣ������¶�Խ����Ҫ������Խ�ߣ���Ҫ���¶�Ϊ70�桢ʱ��Ϊ120min��
(3)��֪�����������Һ����Ԫ��ֻ��Mn2����ʽ���ڣ�����������ԭ��Ӧ�����ӷ���ʽ���������ӻ�̼�����������������������������ӣ�ͬʱ���������ӣ����ӷ���ʽΪ2FeCO3��MnO2��8H��=2Fe3����Mn2����2CO2����4H2O��
(4)���ݱ��е����ݿ�֪��pHΪ5.0ʱ��Fe3+��Al3+������ȫ��pHΪ7.8ʱMn2����ʼ����������pH�ĵ��ط�ΧΪ5.07.8(��5.0��pH<7.8)��
(5)��������Һ�л�����Ԫ�ز�����֤�������Һ���Ƿ�����Ԫ�أ������������Ӽ��ɣ�����Ϊ��ȡ���������еμ�H2O2���ٵ���KSCN��Һ������Һ��죨�������еμ�K3[Fe(CN)6]��Һ����������ɫ��������������Һ�к���FeԪ�أ�
(6)���ݷ�������Һ�к���MnSO4��NH4SO4����Һ����ⷢ���ķ�ӦΪ��2 MnSO4+2H2O![]() 2Mn+O2��+2H2SO4��������ڸù��������п�ѭ�����á�
2Mn+O2��+2H2SO4��������ڸù��������п�ѭ�����á�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��º��ݵ��ܱ������з�����Ӧ��![]() ����˵������ȷ����
����˵������ȷ����
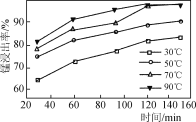
A.�÷�Ӧ��ƽ�ⳣ������ʽ��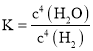
B.�������������ѹǿ���ֲ��䣬˵���÷�Ӧ�Ѵﵽƽ��״̬
C.��![]() �������ı���ʼ����
�������ı���ʼ����![]() ��Ũ�ȣ���ƽ��ʱ
��Ũ�ȣ���ƽ��ʱ![]() ��ת���ʲ���
��ת���ʲ���
D.��2min��![]() Ũ���½���
Ũ���½���![]() ��Ӧ�ٶ�Ϊ
��Ӧ�ٶ�Ϊ![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ϊ2 L�����������ܱ������зֱ����1molSiHCl3��ά���������¶ȷֱ�ΪT1���T2�治�䣬������Ӧ��2SiHCl3(g)![]() SiH2Cl2(g)��SiCl4(g) ��H1��a kJ��mol1����Ӧ������SiHCl3��ת������ʱ��ı仯��ͼ��ʾ������˵����ȷ����
SiH2Cl2(g)��SiCl4(g) ��H1��a kJ��mol1����Ӧ������SiHCl3��ת������ʱ��ı仯��ͼ��ʾ������˵����ȷ����
A.T1��T2
B.T1��ʱ��0~100min��Ӧ��ƽ������v(SiHCl3)��0.001mol��(L��min)��1
C.T2��ʱ����Ӧ��ƽ�ⳣ����K��1/64
D.T2��ʱ��ʹ�ú��ʵĴ�������ʹSiHCl3��ƽ��ת������T1��ʱ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A. ��ϡ��ˮ��μ���ϡ�����У�����ҺpH=7ʱ��c(SO42-)��c(NH4+)
B. ���ִ�����Һ�����ʵ���Ũ�ȷֱ�Ϊc1��c2��pH�ֱ�Ϊa��a+1����c1=10c2
C. pH=11��NaOH��Һ��pH=3�Ĵ�����Һ�������ϣ�����ʯ����Һ�ʺ�ɫ
D. ��0.1 mol/L�İ�ˮ�м�����������粒��壬����Һ��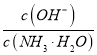 ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CaSO4����O2��ȼ�Ϸ�Ӧ��һ�ָ�Ч����ࡢ���õ�����ȼ�ռ�������ͼ1��ʾ��
ȼ�����з�Ӧ�� 1/4CaSO4(s�� + H2(g�� = 1/4CaS(s�� + H2O(g�� ��H1 (����Ӧ��
��Ӧ�� CaSO4(s�� + H2(g�� = CaO(s�� + SO2��g��+ H2O(g�� ��H2 (����Ӧ��
�������з�Ӧ��1/2 CaS(s�� + O2(g�� = 1/2CaSO4(s�� ��H3
��1��������Ӧ���з�����Ӧ�Ļ�ѧ����ʽ��_____________________��
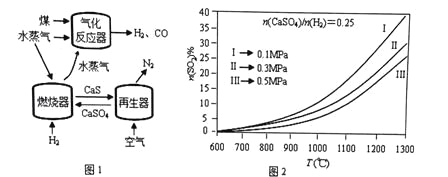
��2��ȼ������SO2���ʵ����������¶�T��ѹǿp (MPa���ı仯����ͼ2����ͼ2�п��Եó�������Ҫ���ɣ�
�������������䣬�¶�Խ�ߣ�SO2����Խ�ߣ�
��________________________________________________________��
��_________________________________________________________��
��ͼ2��Ϊ����SO2���ŷ������ɲ�ȡ�Ĵ�ʩ��______________________��
��3����ȼ�ռ����п�ѭ�������ʳ�CaSO4��CaS�⣬����_________��д���ƣ���
��4����һ�������£�CO����ױ���Ӧ�����䱽����λ������һ��ȩ��������Ľṹ��ʽΪ___________��
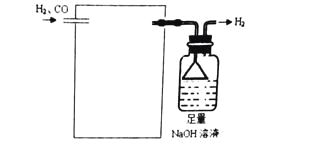
��5���������Ȼ��٣�PdCl2����Һ��ȥH2�е�CO���������ʵ��װ��ͼ��
��ע��CO + PdCl2 + H2O �� CO2+ Pd + 2HCl��______________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£������ݻ���Ϊ2.0 L�����ܱ������з�����Ӧ2NO(g)��2CO(g)![]() N2(g)��2CO2(g)������������ʼ���ʵ���Ũ���뷴Ӧ�¶����±���ʾ��
N2(g)��2CO2(g)������������ʼ���ʵ���Ũ���뷴Ӧ�¶����±���ʾ��
���� | �¶�/�� | ��ʼ���ʵ���Ũ��/(mol��L��1) | |||
NO(g) | CO(g) | N2 | CO2 | ||
�� | T1 | 0.10 | 0.10 | 0 | 0 |
�� | T2 | 0 | 0 | 0.10 | 0.20 |
�� | T2 | 0.10 | 0.10 | 0 | 0 |
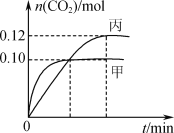
��Ӧ�����мס���������CO2�����ʵ������仯��ϵ��ͼ��ʾ������˵����ȷ����
A.�÷�Ӧ������ӦΪ���ȷ�Ӧ��ƽ�ⳣ��K(T1)<K(T2)
B.�ﵽƽ��ʱ���������е�ѹǿһ�����ڼ�������2��
C.�������з�Ӧ�ﵽƽ��ʱ��N2��ת���ʴ���40%
D.�������з�Ӧ�ﵽƽ����ٳ���0.10 mol NO��0.10 mol CO2����ʱv(��)>v(��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾCalanolide A��һ�ֿ�HIVҩ����й���Calanolide A��˵����ȷ����

A.��������3������̼ԭ��
B.����������̼ԭ��һ����ͬһƽ����
C.�����ʿɷ���ȡ�����ӳɡ���ȥ��Ӧ
D.1 mol��������NaOH��Һ��ַ�Ӧ�������3 mol NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T ��ʱ�����ݻ�Ϊ2 L��3�������ܱ������з�����Ӧ��3A(g)��B(g)![]() nC(g)������ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
nC(g)������ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
���� | �� | �� | �� |
��Ӧ���Ͷ���� | 3 mol A��2 mol B | 6 mol A��4 mol B | 2 mol C |
�ﵽƽ���ʱ��/min | 5 | 8 | |
A��Ũ��/mol��L��1 | c1 | c2 | |
C���������% | w1 | w3 | |
���������ܶ�/g��L��1 | ��1 | ��2 |
����˵����ȷ����(����)
A. ��n<4����2c1<c2
B. ��n��4����w3��w1
C. ����n��ֵ�Ƕ��پ���2��1����2
D. �����״ﵽƽ�������ʱ��������Ҵﵽƽ�������ʱ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵������ȷ����
A.28 g��ϩ�����Ĺ��õ��Ӷ���ĿΪ2NA
B.133.5 g AlCl3���庬�е�������ĿΪ4NA
C.0.1 mol Cl2������ʯ���鷴Ӧ��ת�Ƶ��ӵ���ĿΪ0.2NA
D.��0.2 mol NH4NO3����ϡ��ˮ��ʹ��Һ�����ԣ���Һ��NH![]() ����ĿΪ0.2NA
����ĿΪ0.2NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com