
| A. | 两种物质所含原子个数之比为4:3 | |
| B. | 两种物质与水充分反应,生成的氢氧化钠质量之比为2:1 | |
| C. | 两种物质与足量的CO2反应,消耗气体的质量比为1:1 | |
| D. | 两种物质中阳离子的物质的量之比为1:1 |
分析 A.1molNa2O2含有4mol原子,1molNa2O含有3mol原子;
B.根据Na2O2和Na2O 分别和水反应2Na2O2+2H2O=4NaOH+O2↑,Na2O+H2O=2NaOH分析;
C.根据两种物质与足量的CO2反应2Na2O2+2CO2=2Na2CO3+O2↑,Na2O+CO2=Na2CO3分析;
D.Na2O2由钠离子与过氧根离子构成,Na2O由钠离子与阳离子构成.
解答 解:A.1molNa2O2含有4mol原子,1molNa2O含有3mol原子,故相同物质的量的Na2O2和Na2O的含有原子数目之比是4:3,故A正确;
B.Na2O2和Na2O 分别和水反应2Na2O2+2H2O=4NaOH+O2↑,Na2O+H2O=2NaOH,相同物质的量的Na2O2和Na2O与水充分反应,生成的氢氧化钠质量之比为1:1,故B错误;
C.两种物质与足量的CO2反应,分别发生2Na2O2+2CO2=2Na2CO3+O2↑,Na2O+CO2=Na2CO3,相同物质的量的Na2O2和Na2O 则消耗气体的物质的量、质量比均为1:1,故C正确;
D.Na2O2由钠离子与过氧根离子构成,1molNa2O2含有2mol钠离子,Na2O由钠离子与阳离子构成,1molNa2O含有2mol钠离子,相同物质的量的Na2O2和Na2O含有阳离子的物质的量之比为1:1,故D正确,
故选:B.
点评 本题考查物质的量计算,涉及微粒数目计算,明确发生的化学反应及相关的概念是解答本题的关键,注意根据反应的相关方程式进行计算该题,题目难度中等.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 明矾在水中生成的Al(OH)3胶体有吸附性,因此常用明矾对水进行消毒 | |
| B. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧产生的 | |
| C. | 氨气很容易液化,液氨汽化吸收大量的热,所以液氨常用作制冷剂 | |
| D. | 为了消除碘缺乏病,在食用盐中加入一定量的碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 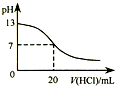 如图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 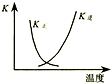 图中曲线表示反应2SO2(g)+O2(g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 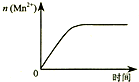 图③表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 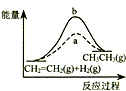 图中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe→Fe2O3→Fe(OH)3 | B. | SO2→SO3→H2SO4 | ||
| C. | FeCl2→Fe(OH)2→Fe(OH)3 | D. | NO→NO2→HON3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 放电时,锂为负极,发生还原反应 | |
| B. | 充电时阳极反应式为:8Li2S-16e-═S8+16Li+ | |
| C. | 电解质可采用导电有机电解质 | |
| D. | 锂硫电池的理论电压为2.0V,则单位质量的单质硫的比能量为3.35 kW•h/kg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 尿素CO(NH2)2 | B. | NH4NO3 | C. | NH4HCO3 | D. | (NH4)2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com