
| A. | 5 9 6 | B. | 5 6 6 | C. | 3 9 7 | D. | 4 6 7 |
分析 苯环上有一个侧链,乙苯侧键是碳碳键之间插-NH-,有两种位置,得到两种结构,在碳氢单键之间插-NH-,也有两种位置,氮原子与苯环相连且氮原子连有两个甲基为一种,所以苯环上有一个侧链的结构有5种,若苯环含有2个侧链,有邻,间,对三种取代,苯环上的取代基可以是氨基与乙基、甲基与甲氨基、甲基与氨甲基,故苯环上2个取代基时共9种,若苯环进行3取代,取代基为2个甲基和氨基,有6种产物.
解答 解:苯环上有一个侧链,乙苯侧键是碳碳键之间插-NH-,有两种位置,得到两种结构,在碳氢单键之间插-NH-,也有两种位置,氮原子与苯环相连且氮原子连有两个甲基为一种,所以苯环上有一个侧链的结构有5种,若苯环含有2个侧链,有邻,间,对三种取代,苯环上的取代基可以是氨基与乙基、甲基与甲氨基、甲基与氨甲基,故苯环上2个取代基时共9种,若苯环进行3取代,取代基为2个甲基和氨基,有6种产物.
故答案为:A.
点评 本题主要考查的是同分异构体数目的判断,利用等效H法是解决此类题目的常用方法,希望认真整理,以便掌握.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
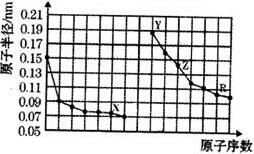
| A. | X、Y两种单质在常温下反应生成的产物为碱性氧化物 | |
| B. | Z2R3可由Y2R和ZCl3的溶液反应制取 | |
| C. | Y、Z、R三种元素对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
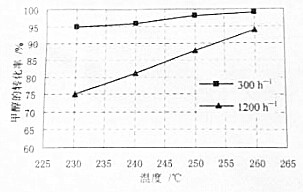 以高纯H2燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向.
以高纯H2燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0L1.0mol•L-1的KAlO2水溶液中含有的氧原子数为2NA | |
| B. | 标准状况下,当活泼金属转移2NA个电子时,可从盐酸中置换产生44.8LH | |
| C. | 6.0g液态NaHS04中含有0.1NA个阳离子 | |
| D. | 1molH202分子中非极性共价键数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
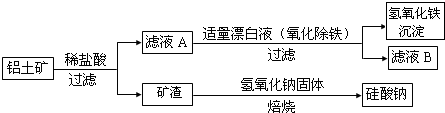
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

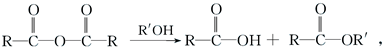

 .
. .
.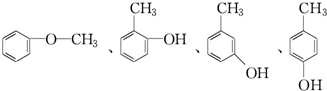 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2 | B. | +4 | C. | 0 | D. | +6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
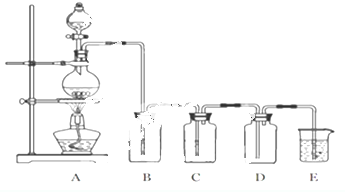
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com