
LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠.已知该电池放电时的电极反应式为:正极FePO4+Li++e-===LiFePO4,负极Li-e-===Li+.下列说法中正确的是
( )
A.充电时的总反应为FePO4+Li===LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电源的正极相连
C.放电时电池内部Li+向负极移动
D.放电时,在正极上是Li+得电子被还原
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源: 题型:
 短周期元素X、Y、Z在周期表中的位置关系如右图所示,据此回答下列问题:
短周期元素X、Y、Z在周期表中的位置关系如右图所示,据此回答下列问题:
(1)X元素形成单质的分子式是__________;
(2)写出Y元素形成的单质跟水反应的化学方程式:_____________;
(3)写出单质Z与钠反应的化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g)
M(g)+N(g)
所得实验数据如下表:
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
回答下列问题:
(1)实验①中,若5min时测得,n(M)=0.050mo1, 则0至5min时间内,用N表示的平均反应速率为________。
(2)实验③平衡常数为___________,该正反应为____________反应(填“吸热”或“放热”)
(3)能说明上述反应一定达到平衡的条件是_______________________。
A. c(Y)= c(N) B.平均分子量不再变化
C. v正(X) =v逆(M) D.温度和压强一定时,混合气体的密度不再变化
(4)实验③中,达到平衡时,X的转化率为_________________________。
(5)实验③、④中,达到平衡时,a与b的关系为__________(填选项),请解释原因________________。
A. a>2b B. a=2b C.b<a<2b D.a<b
(6)图是实验①中c(M)随时间变化的曲线图,请在图中画出实验②中c(M)随时间变化的曲线图。
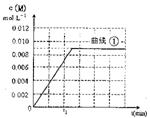
查看答案和解析>>
科目:高中化学 来源: 题型:
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如下图所示(a、b为石墨电极).下列说法中,正确的是 ( )

A.电池工作时,正极反应式为:O2+2H2O+4e-===4OH-
B.电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗0.02 g H2时,b极周围会产生0.04 g H2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知NaHSO4在水中的电离方程式为NaHSO4===Na++H++SO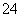 ,某温度下,向pH=6的蒸馏水中加NaHSO4晶体,保持温度不变,测得溶液的pH=2,对于该溶液,下列叙述中不正确的是 ( )
,某温度下,向pH=6的蒸馏水中加NaHSO4晶体,保持温度不变,测得溶液的pH=2,对于该溶液,下列叙述中不正确的是 ( )
A.该温度高于25℃
B.水电离出的c(H+)=1×10-10 mol/L
C.c(H+)=c(OH-)+c(SO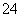 )
)
D.该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
对于常温下pH为1的硝酸溶液,下列叙述正确的是 ( )
A.该溶液1 mL稀释至100 mL后,pH等于2
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12
D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应A(g)+B⇌C(g)+D,达到平衡时,下列说法不正确的是( )
|
| A. | 若B是气体,增大A的浓度会使B转化率增大 |
|
| B. | 若增大A的浓度,平衡体系颜色加深,则D是有颜色的气体 |
|
| C. | 升高温度,C百分含量减少,说明正反应是放热反应 |
|
| D. | 增大压强,平衡不移动,说明B、D有可能是非气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有①Na2CO3溶液;②CH3COONa溶液;③NaOH溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )
|
| A. | 三种溶液pH的大小顺序是③>②>① |
|
| B. | 若将三种溶液稀释相同倍数,pH变化最大的是② |
|
| C. | 若分别加入25mL 0.1mol/L盐酸后,pH最大的是① |
|
| D. | 若三种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com