
(14��)������Ϊһ���ִ���ͨ�������ڽ���ǧ��������β���к���CO��NOx���ж����壬����Ⱦ����Ҳ��Ϊ������ἱ���������⡣
��1����������������ʱ������N2��O2��Ӧ���������仯ʾ��ͼ��ͼ��
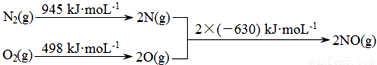
��÷�Ӧ���Ȼ�ѧ����ʽΪ ��
��2����������װβ������װ�ã���ʹCO��NOx�ж��������Ӧת��Ϊ�����塣
2xCO��2NOx == 2xCO2��N2����ת�Ƶ������ʵ���Ϊ0.4x molʱ���÷�Ӧ���ɱ�״���µ�N2��� L��
��3��һ����̼��һ����;�൱�㷺�Ļ�������ԭ�ϡ����Ի�ԭ��������������������ϳɺܶ��л�����״��ȡ���ѹǿΪ0.1 MPa�����£���a mol CO��3a mol H2�Ļ�������ڴ��������·�Ӧ���ɼ״��� CO(g)��2H2(g)  CH3OH(g)����H�� -b kJ?mol-1
CH3OH(g)����H�� -b kJ?mol-1
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ ��
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ��� ��
A�������¶� B����CH3OH(g)����ϵ�з���
C������He��ʹ��ϵ��ѹǿ���� D���ٳ���1 mol CO��3 mol H2
�۾��ⶨ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����£�
�¶ȣ��棩 | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
��ijʱ�̡�250���ø÷�Ӧ�ķ�Ӧ�����������Ũ��Ϊc(CO) ��0.4 mol/L��c(H2)��0.4 mol/L��c(CH3OH)��0.8 mol��L��1, ���ʱv�� v��(�������)��
��4���״�����Ҫ�Ļ�������ԭ�ϣ�����һ�����͵�ȼ�ϣ��������������һ��ȼ�ϵ�أ�һ���缫ͨ���������һ���缫����״�����صĵ�����Dz�����Y2O3��ZrO2���壬���ڸ������ܴ���O2-���ӡ��õ�ص�������ӦʽΪ_____________________________����ع���ʱ�������������O2-��_______���ƶ���
��1��N2(g)+O2(g)=2NO(g)����H=+183 kJ/moL ��2�֣� ��2��2.24L ��2�֣�
��3����K=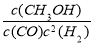 ��2�֣� ��BD ��2�֣� �� �� ��2�֣�
��2�֣� ��BD ��2�֣� �� �� ��2�֣�
��4��O2+4e-=2O2- ��2�֣� �� ��2�֣�
��������
�����������1�����ݻ�ѧ��Ӧ���ʱ���ڷ�Ӧ��ļ���֮�ͼ�ȥ������ļ���֮�ͣ���������仯ʾ��ͼ֪1molN2��1molO2����2molNO���ʱ�Ϊ+183 kJ/moL����÷�Ӧ���Ȼ�ѧ����ʽΪN2(g)+O2(g)=2NO(g)����H=+183 kJ/moL����2����Ӧ2xCO��2NOx == 2xCO2��N2ת�Ƶĵ�����Ϊ4x����ת�Ƶ������ʵ���Ϊ0.4x molʱ���÷�Ӧ���ɱ�״���µ�N2���2.24L����3���� ���������ѧ����ʽ�ͻ�ѧƽ�ⳣ������ʽ����дԭ����д���÷�Ӧ��ƽ�ⳣ������ʽΪK=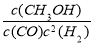 ���� A���ϳɼ״��ķ�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ����״��IJ��ʽ��ͣ�����B����CH3OH(g)����ϵ�з��룬ƽ�������ƶ����״��IJ������ӣ���ȷ��C���ݻ����������³���He��ʹ��ϵ��ѹǿ����ƽ�ⲻ�ƶ����״��IJ��ʲ��䣬����D���ٳ���1 mol CO��3 mol H2�൱������ѹǿ��ƽ�������ƶ����״��IJ������ӣ���ȷ��ѡBD���� ����������ݼ��㣺Q=
���� A���ϳɼ״��ķ�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ����״��IJ��ʽ��ͣ�����B����CH3OH(g)����ϵ�з��룬ƽ�������ƶ����״��IJ������ӣ���ȷ��C���ݻ����������³���He��ʹ��ϵ��ѹǿ����ƽ�ⲻ�ƶ����״��IJ��ʲ��䣬����D���ٳ���1 mol CO��3 mol H2�൱������ѹǿ��ƽ�������ƶ����״��IJ������ӣ���ȷ��ѡBD���� ����������ݼ��㣺Q=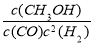 =0.8 mol��L��1/��0.4 mol��L��1��3=12.5��250��ʱ��K=2.041��Q��K����Ӧ������У����ʱv����v�棻��4���״�ȼ�ϵ�أ�һ���缫ͨ�����������������һ���缫����״�������������صĵ�����Dz�����Y2O3��ZrO2���壬���ڸ������ܴ���O2-���ӡ��õ�ص�������ӦʽΪO2+4e-=2O2- ����ع���ʱ�������������O2-���ƶ���
=0.8 mol��L��1/��0.4 mol��L��1��3=12.5��250��ʱ��K=2.041��Q��K����Ӧ������У����ʱv����v�棻��4���״�ȼ�ϵ�أ�һ���缫ͨ�����������������һ���缫����״�������������صĵ�����Dz�����Y2O3��ZrO2���壬���ڸ������ܴ���O2-���ӡ��õ�ص�������ӦʽΪO2+4e-=2O2- ����ع���ʱ�������������O2-���ƶ���
���㣺���黯ѧ��Ӧԭ�����漰�Ȼ�ѧ����ʽ����д����ѧƽ��͵绯ѧ��


 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���ѧ�����л�ѧ���ģ��Ծ��������棩 ���ͣ�ѡ����
������ԴΣ��Ӱ��ļӾ磬ȫ��Ѱ������Դ�IJ����ӿ죬���м�����Դ�в���������Դ����
A��ʯ�� B������ C��̫���� D����ϫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡ������ѧ�ڵ��Ĵ��¿���ѧ�Ծ��������棩 ���ͣ������
(12��)X��Y��WΪԭ���������ε����Ķ�����Ԫ�أ�X��Yͬ���壬Y���⻯���W���⻯�������ͬ�ĵ�����������ѧ��Χ��X�ĵ���ֻ�������ԣ����ǿ�������Ҫ�ɷ�֮һ��
��1��д��ʵ������ȡW2��Ӧ�����ӷ���ʽ ��
��2��ijС�������ͼ��ʾ��װ�ã��ֱ��о�YX2��W2�����ʡ�
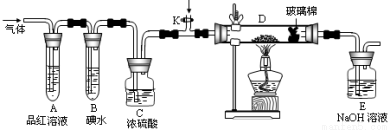
�ٷֱ�ͨ��YX2��W2����װ�� A�й۲쵽�������Ƿ���ͬ �����ͬ������ͬ��������װ��D��װ�������ۣ���ͨ������W2ʱ�۲쵽������Ϊ ����װ��D��װ����������������������������ͨ������YX2ʱ����Kͨ������X2����ѧ��Ӧ����ʽΪ ��
A�й۲쵽�������Ƿ���ͬ �����ͬ������ͬ��������װ��D��װ�������ۣ���ͨ������W2ʱ�۲쵽������Ϊ ����װ��D��װ����������������������������ͨ������YX2ʱ����Kͨ������X2����ѧ��Ӧ����ʽΪ ��
����װ��B��װ��5��0mL 1��0 ��10-3mol/L�ĵ�ˮ����ͨ������W2��ȫ��Ӧ��ת����5��0��10-5mol���ӣ��÷�Ӧ�Ļ�ѧ����ʽΪ
��10-3mol/L�ĵ�ˮ����ͨ������W2��ȫ��Ӧ��ת����5��0��10-5mol���ӣ��÷�Ӧ�Ļ�ѧ����ʽΪ  ��
��
��3��ijͬѧ��������YX2ͨ��һ֧װ���Ȼ�����Һ���Թܣ�δ���������ɣ�������Թ��м��������������ҺҲ�������ɵ��� ������ĸ����
A����ˮ
B��ϡ����
C��ϡ����
D���Ȼ���
E��˫��ˮ
F��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡ������ѧ�ڵ��Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪A��B��C��D��E�Ƕ�������ԭ���������������5������Ԫ�أ�����Ԫ��A��E�ĵ����ڳ����³���̬��Ԫ��B��ԭ������������������Ӳ�����2����Ԫ��C��ͬ���ڵ�����Ԫ���� ԭ�Ӱ뾶���Ԫ��D��
ԭ�Ӱ뾶���Ԫ��D�� �Ͻ����ճ������г��õĽ������ϡ�����˵����ȷ����
�Ͻ����ճ������г��õĽ������ϡ�����˵����ȷ����
A��Ԫ��A��B��ɵĻ����ﳣ����һ������̬
B��Ԫ ��C��D������������Ӧ��ˮ����֮�䲻�ܷ�����Ӧ
��C��D������������Ӧ��ˮ����֮�䲻�ܷ�����Ӧ
C����ҵ�ϳ��õ�ⷨ�Ʊ�Ԫ��C��D��E�ĵ���
D��������AE��CE������ͬ���͵Ļ�ѧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡ������ѧ�ڵ��Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й�˵���������
A��ҽҩ�г��þƾ�����������Ϊ�ƾ���ʹϸ�������ʱ���
B��������ά�����ά�������л��߷��Ӳ���
C���ԷϾɵ�ػ��մ�����Ϊ�˷�ֹ�ؽ�����ȾˮԴ������
D����ɫ��ѧ�ĺ����Ǵ�Դͷ�ϼ��ٺ��������������Ի�������Ⱦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����������и�����ѧ�ڵ������¿������Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��д��ȷ����
A��̼�������Һ��������������Һ��ϣ�Ca2++2HCO3����OH����CaCO3��+CO32����H2O
B��CuCl2��Һ��Na2S��Һ2:1��Ӧ��Cu2++ S2��= CuS��
C����Ũ�����ữ��KMnO4��Һ��H2O2��Ӧ��֤��H2O2���л�ԭ�ԣ�2MnO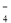 + 6H+ + 5H2O2 �� 2Mn2+ + 5O2�� + 8H2O
+ 6H+ + 5H2O2 �� 2Mn2+ + 5O2�� + 8H2O
D����������Һ�еμ�Ba(OH)2��Һ��ǡ��ʹSO42-������ȫ��2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3��+3BaSO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ������ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ������
��12�֣�A��B��C��DΪԭ������������������ֶ�����Ԫ�أ������ʻ�ṹ��Ϣ���±���
Ԫ�� | A | B | C | D | E |
���� ��� ���� Ϣ | �����µ��ʳ���̬��ԭ��������������D��ͬ | D3B���������������ӵĵ��Ӳ�ṹ��ͬ | A��C���γ����ֳ����Ļ�������ң��Ҿ��������� | ��������������ɫ���塢������ǿ���ڿ�����ȼ�����ɵ���ɫ���� | E����̬�⻯�������������Ӧ��ˮ�����Ϊǿ�ᣬC��D��E����Ԫ���γɵ�һ���α�Ϊij����Һ����Ҫ�ɷ� |
�Իش���������
��1��B�����ڱ��е�λ���� ��B���⻯����E���⻯��Ƚϣ��е�ϸߵ��� ���ѧʽ����
��2��D3B����ˮ��Ӧ����2�ּ������ʣ���д����һ��ѧ����ʽ ��
��3��д�����ĵ���ʽΪ ����˵�����ڿ�����Ư��ԭ�����û�ѧ����ʽ��ʾ�� ������ο��±����ݣ�
�� | ���볣�� |
HClO | Ka=3.0��10-8 |
H2CO3 | Ka1=4.3��10-7��Ka2=5.6��10-11 |
��4����A��B��C��D����Ԫ���е�����Ԫ����ɵ�һ���ζ�����������Ȼ������ƣ�����ˮ��Һ�ʼ��ԡ���������ͭ˿���붡��Һ�У�û�������������������ữ����ӦѸ�ٷ�����ͭ˿�����ܽ���������ɫ��Һ��д���÷�Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ������ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ܱ������зֱ����Ne��H2��O2�������壬�����ǵ��¶Ⱥ��ܶȶ���ͬʱ�������������ѹǿ��p����С�������
A��p (Ne) < p (H2) < p (O2) B��p (H2) < p (O2) < p (Ne)
C��p (O2) < p (Ne) < p (H2) D��p (H2) < p (Ne) < p (O2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡ�����и���12��У�����ϼ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
���й������ʵ�������Ӧ�����Ӧ����
A�������ж���������������ˮ��ɱ������
B��FeCl3��Һ����Cu��Ӧ��������ʴ��ӡˢ��·
C����۾��л�ԭ�ԣ�����������ڻ�ҩ
D��Na2O2����ǿ�����ԣ�������������ߵĹ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com