
A、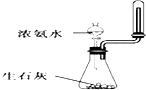 制取少量氨气 |
B、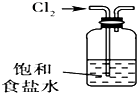 除去氯气中的HCl杂质 |
C、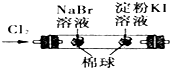 证明氧化性Cl2>Br2>I2 |
D、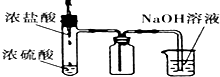 制取HCl且除去多余的气体 |


科目:高中化学 来源: 题型:
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
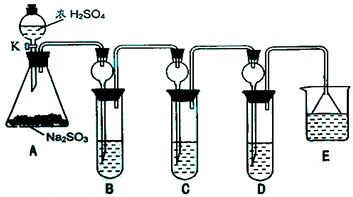 某研究小组欲探究SO2的化学性质,设计了如右图所示实验方案.
某研究小组欲探究SO2的化学性质,设计了如右图所示实验方案.| 实验操作 | 预期现象和结论 |
| 将D中沉淀过滤、洗涤干净备用. | / |
| 用另一干净试管取少量沉淀样品,加入 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c( OH-) |
| B、c(Na+)=c(H2SO3)+c(HSO3-)+c( H+) |
| C、c(SO32-)+c( OH-)=c(H+)+c(H2SO3) |
| D、c(Na+)>c(HSO3-)>c( OH-)>c(H2SO3)>c(SO32-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | △H | |||
| ① | 50mL0.55mol?L-1 NaOH溶液 | 50mL0.5mol?L-1 HCl溶液 | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol?L-1 NaOH溶液 | 50mL0.5mol?L-1 HCl溶液 | 20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、OH-、Ba2+、NO3-、K+ |
| B、Fe2+、Ca2+、Br-、NO3- |
| C、Na+、SO42-、Cu2+、Cl- |
| D、CO32-、Cl-、Na+、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浸洗前后,被浸洗的食盐中MgCl2的含量基本不变 |
| B、用来浸洗的饱和食盐水在浸洗前后没有变化 |
| C、浸洗用过的饱和食盐水可以无限次地使用下去 |
| D、粉碎颗粒的大小影响浸洗后盐中MgCl2的含量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com