


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
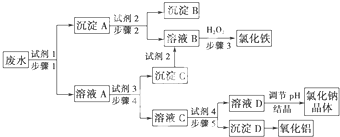
科目:高中化学 来源: 题型:
| NaCN |
| 醇溶液 |
| H2O |
| H2SO4 |
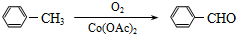
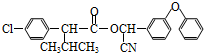 ):
):
 )的一取代物,含有碳碳叁键,X所有可能的结构共有
)的一取代物,含有碳碳叁键,X所有可能的结构共有查看答案和解析>>
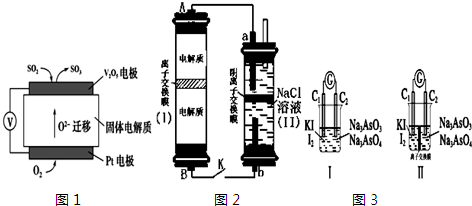
科目:高中化学 来源: 题型:
查看答案和解析>>
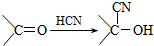
科目:高中化学 来源: 题型:
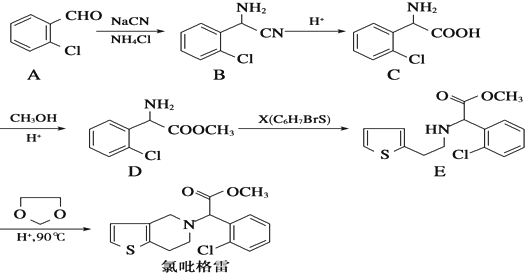
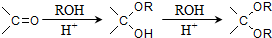
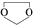 ,需要经历的反应类型有
,需要经历的反应类型有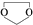 的最后一步反应
的最后一步反应查看答案和解析>>
科目:高中化学 来源: 题型:
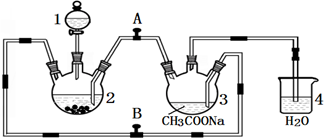
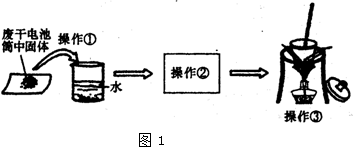 日常生活中使用的锌锰干电池,电池外壳是锌片,中心是石墨棒,在外壳和石墨之间填充二氧化锰和碳粉以及氯化锌及氯化铵的糊状物.某研究性学习小组对干电池的填充物质进行了如图1实验.
日常生活中使用的锌锰干电池,电池外壳是锌片,中心是石墨棒,在外壳和石墨之间填充二氧化锰和碳粉以及氯化锌及氯化铵的糊状物.某研究性学习小组对干电池的填充物质进行了如图1实验.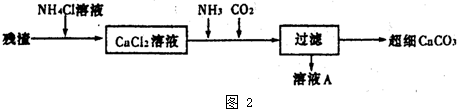
查看答案和解析>>
科目:高中化学 来源: 题型:
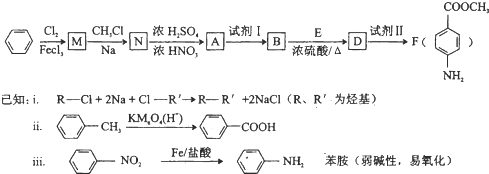
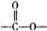 结构.
结构.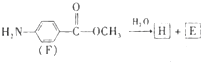
查看答案和解析>>
科目:高中化学 来源: 题型:
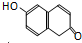 .下列关于该有机物的叙述正确的是( )
.下列关于该有机物的叙述正确的是( )| A、该有机物属于芳香烃 |
| B、该有机物苯环上一氯代物有6种 |
| C、该有机物可发生取代、加成、加聚、消去反应 |
| D、1 mol该有机物在适当条件下,最多可与3 mol Br2、5 mol H2反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com