
| A.25 ℃时,若溶液的pH=11,则Kb(NH3·H2O)=1×10-6 mol·L-1 |
B.向溶液中加入少量CH3COONa固体,溶液中的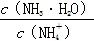 值变小 值变小 |
C.向溶液中加入10 mL 0.1 mol·L-1 HCl,所得溶液中离子浓度大小顺序为c(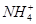 )>c(Cl-)>c(H+)>c(OH-) )>c(Cl-)>c(H+)>c(OH-) |
D.向溶液中加入5 mL 0.1 mol·L-1 HCl,所得溶液中离子的浓度一定符合:c(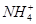 )+c(H+)=c(Cl-)+c(OH-) )+c(H+)=c(Cl-)+c(OH-) |
科目:高中化学 来源:不详 题型:单选题
| A.pH=1的溶液:Na+、CO32-、Cl-、Ca2+ |
| B.水电离的c(H+)=1.0×10-13的溶液:K+、HCO3-、SO42-、NH4+ |
| C.c(OH-)/c(H+)=1.0×10—12的溶液:Fe2+、NO3-、K+、Cl- |
| D.含有Ba2+离子溶液:AlO2-、Na+、NO3-、NH4+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.通入NO2:Na+、Fe2+、Cl-、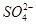 |
B.通入NH3: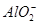 、 、 、Na+、 、Na+、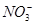 |
C.通入Cl2:K+、 、I-、Cl- 、I-、Cl- |
D.通入CO2:Na+、K+、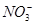 、 、 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.相同浓度和体积的强碱和强酸溶液混合后,溶液的pH=7 |
B.在NaHCO3溶液中,c(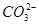 )>c( )>c(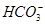 ) ) |
| C.在有AgCl沉淀的溶液中加入NaCl固体,c(Ag+)减小 |
| D.将pH相等的CH3COONa和Na2CO3溶液稀释相同倍数,CH3COONa溶液的pH较大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大 |
B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c( )>c(H+)=c(OH-) )>c(H+)=c(OH-) |
| C.中和pH与体积均相同的盐酸和醋酸,消耗NaOH溶液的物质的量相同 |
| D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
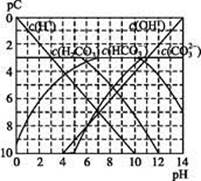
 能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。 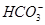 的水解程度 电离程度(填“<”“>”或“=”)。
的水解程度 电离程度(填“<”“>”或“=”)。 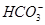 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。 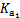 ≈ 。
≈ 。  不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确。
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确。 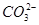 )="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
)="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Al3+、Na+、NO3-、Cl- | B.K+、Na+、Cl-、SO42- |
| C.K+、Na+、Cl-、CO32- | D.K+、I-、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ba2+、Mg2+、NO3-、CO32- |
| B.H+、Ba2+、Al3+、Cl- |
| C.K+、Ba2+、Cl-、HCO3- |
| D.NH4+、Ba2+、Fe3+、Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将pH=6的H2SO4稀释1000倍后,c(H+)=" 2" c(SO42—) |
| B.0.1 mol L-1的 Na2CO3溶液中:c(OH— ) = c(HCO3— ) + c(H+) + c(H2CO3) |
| C.浓度均为0.1 mol L-1 '的 NaClO 溶液和 CH3COONa 溶液中,c(ClO—)﹤c(CH3COO—) |
| D.浓度分别为0.1 mol L-1和0.01 mol L-1的CH3COOH溶液中:c(CH3COO—)前者是后者的10倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com