
| 实验步骤 | 实验操作 |
| Ⅰ | 取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温. |
| Ⅱ | 取少量实验步骤Ⅰ所得固体放于一洁净的试管中,用足量的稀硫酸溶解. |
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红. |
| ||
| 0.02×c×10-3mol×5×116g |
| 1mol×c% |


科目:高中化学 来源: 题型:

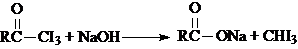
| A、CH3CHO |
| B、CH3CH2CHO |
| C、CH3CH2COCH2CH3 |
| D、CH3COCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4LN2含有分子数为NA |
| B、物质的量浓度为22.4 mol/L MgCl2溶液,含有Cl-数为NA |
| C、标准状况下,22.4 LH2O的分子数为NA |
| D、64g SO2含有氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
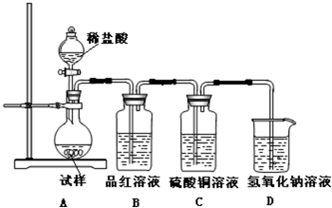
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | ① | ② | ③ | ④ |
| 装置 |  | 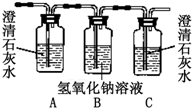 | 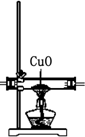 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:
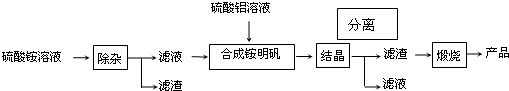
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| 物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS |
| Ksp | 8.8×10-36 | 2.2×10-20 | 5.48×10-16 | 3.2×10-19 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+ K+ HCO3- Cl- |
| B、NH4+ Mg2+ SO42- Cl- |
| C、K+ Na+ SO42- CH3COO- |
| D、K+ Ca2+ CO32- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com