
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:物理教研室 题型:022
温度/℃ 550 650 750 850 897
压强/Pa 5.32×10 9.17×102 8.37×103 4.94×104 1.01×105
请按要求填空:
(1)若升高原CaCO3分解平衡体系的温度。同时给反应容器加压,则原平衡________。
( )
A. 向左移动
B. 向右移动
C. 不移动
D. 无法确定平衡移动方向
(2)在一个与外界不能进行热交换的密闭容器中,足量的CaCO3在850℃时建立了分 解平衡。若将该容器的容积扩大为原来的2倍,当重新达到平衡时容器内的温度将 ________,CO2的平衡压强将________4.94×104Pa,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:022
反应CaCO3=CaO+CO2↑在不同温度下,CO2的平衡压强如下表:
温度/℃ 550 650 750 850 897
压强/Pa 5.32×10 9.17×102 8.37×103 4.94×104 1.01×105
请按要求填空:
(1)若升高原CaCO3分解平衡体系的温度。同时给反应容器加压,则原平衡________。
( )
A. 向左移动
B. 向右移动
C. 不移动
D. 无法确定平衡移动方向
(2)在一个与外界不能进行热交换的密闭容器中,足量的CaCO3在850℃时建立了分 解平衡。若将该容器的容积扩大为原来的2倍,当重新达到平衡时容器内的温度将 ________,CO2的平衡压强将________4.94×104Pa,理由是________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市崇明县高三高考模拟考试(二模)化学试卷(解析版) 题型:填空题
(共10分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用焦炭与水蒸气在高温下的反应产物(水煤气)合成二甲醚。请回答下列问题:
(1)、制水煤气的主要化学反应方程式为: 。
(2)、煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为: 。
(3)、利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) CO(g)
CO(g) CH3OH(g)
CH3OH(g) 90.8 kJ
90.8 kJ
② 2CH3OH(g) CH3OCH3(g)
CH3OCH3(g) H2O(g)
H2O(g) 23.5 kJ
23.5 kJ
③ CO(g) H2O(g)
H2O(g) CO2(g)
CO2(g) H2(g)
H2(g) 41.3 kJ
41.3 kJ
总反应:3H2(g) 3CO(g)
3CO(g) CH3OCH3(g)
CH3OCH3(g) CO2(g)
CO2(g) Q,其中Q
Q,其中Q kJ;
kJ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
(填字母代号)。
a.低温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度
(4)、已知某温度下反应②2CH3OH(g) CH3OCH3(g)
CH3OCH3(g) H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L |
0.44 |
0.6 |
0.6 |
比较此时正、逆反应速率数值(单位相同)的大小: (甲醇)
(甲醇)  (水)(填“>”、“<”或“=”)。
(水)(填“>”、“<”或“=”)。
反应开始时 (CH3OH)
(CH3OH) ;
;
该时间内的平均反应速率 (CH3OH)
(CH3OH) ;
;
该温度下反应的平衡常数值为 。(精确到0.01)
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2 (g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
(2)甲烷在高温下与水蒸气反应的方程式为:CH4+H2O=CO+3H2。已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ?mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566kJ?mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ?mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CH4和H2O在高温下反应的热化学方程式 。
(3)在25℃下,向浓度均为0.1 mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl―NH4Cl为电解质溶液制造新型燃烧电池。请写出该电池的正极反应式 。
(5)某温度(t℃)时,测得0.01mol?L-1的NaOH溶液的pH=11。在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,且a+b=12,则Va :Vb= 。
(6)在25℃下,将a mol?L-1的氨水与0.01 mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3?H2O的电离常数Kb=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图示与对应叙述相符合的是 ( )
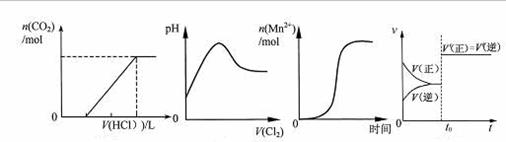
图1 图2 图3 图4
A.图2表示Cl2通入SO2溶液中pH的变化
B.图3表示10 mL 0.01 mol·L-1KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4 溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用)
C.图1表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol·L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系
D.图4表示已达平衡的某可逆反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com