
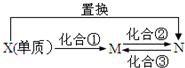
 M、N为含X元素的常见化合物,它们之间有如图的转化关系.下列说法正确的是( )
M、N为含X元素的常见化合物,它们之间有如图的转化关系.下列说法正确的是( )| A. | X可以是Mg或Cu元素 | |
| B. | 化合②③的反应可以是非氧化还原反应 | |
| C. | 若X为C元素,则该转化关系中X单质发生的置换反应可以是2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO | |
| D. | 若X为Fe元素,则M的H218O溶液中加入固体Na2O2的反应为:4Fe3++6H218O+6Na2O2═4Fe(OH)3↓+12Na++318O2↑ |
分析 由于M、N为含X元素的常见化合物,而M和N之间可以通过化合反应相互转化,故可知M和N中X元素的化合价不同,即元素X必须为变价元素,据此分析.
解答 解:A、元素X必须为变价元素,而镁元素不是变价元素,故A错误;
B、M和N中X元素的化合价不同,故化合②③的反应一定是氧化还原反应,故B错误;
C、若X为C元素,则M可以为CO2,N可以为CO,X单质发生的置换反应可以是2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO,故C正确;
D、若X为铁元素,则M为FeCl3,N为FeCl2,向M的H218O溶液中加入固体Na2O2时,Na2O2先和H218O发生歧化反应:2Na2O2+2H218O=4Na18OH+O2↑,然后生成的Na18OH再和氯化铁反应,故总的离子方程式为:4Fe3++6H218O+6Na2O2═4Fe(18OH)3↓+12Na++3O2↑,故D错误.
故选C.
点评 本题考查而来元素化合物的推导和离子方程式的书写,应注意的是过氧化钠和水的反应中,过氧化钠发生歧化反应,氧气中的氧原子来自于过氧化钠.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| C. | 向NaAlO2溶液中通人过量CO2制Al(OH)3:AlO2-+CO2+H2O═Al(OH)3↓+HCO3- | |
| D. | 向含2molAlCl3的溶液中加入1L 7mol/L的NaOH溶液:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
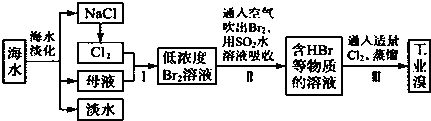
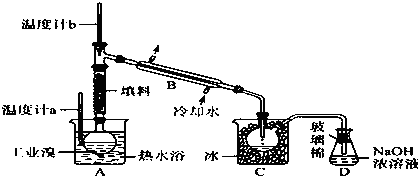
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相同的①CH3COONa、②NaHCO3、③C6H5ONa,三份溶液中的c(Na+):③>②>① | |
| B. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)═2c(A2-)+c(HA-)+c(H2A) | |
| C. | 在电解食盐水的实验中,若电解后溶液总体积为1L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为12 | |
| D. | 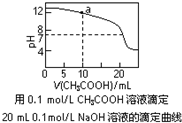 如图中a点溶液中各离子浓度的关系是:c(OH-)═c(H+)+c(CH3COO-)+2c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | B. | c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | ||
| C. | c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | D. | c(Na+)+c(OH-)=c(CH3COO-)+c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com